Азот - это всем известный химический элемент, который обозначается буквой N. Этот элемент, пожалуй, основа неорганической химии, его начинают подробно изучать еще в 8 классе. В данной статье мы рассмотрим данный химический элемент, а также его свойства и типы.
Азот - это элемент, который впервые был представлен знаменитым французским химиком Антуаном Лавуазье. Но за звание первооткрывателя азота борются многие ученые, среди них и Генри Кавендиш, Карл Шееле, Даниэль Резерфорд.
Генри Кавендиш в результате опыта первым выделил химический элемент, но так и не понял, что он получил простое вещество. О своем опыте он сообщил Джозефу Пристли, который тоже проделывал ряд исследований. Вероятно, Пристли тоже удалось выделить этот элемент, но ученый не смог понять, что именно он получил, поэтому не заслужил звание первооткрывателя. Карл Шееле одновременно с ними проводил те же исследования, но не пришел к нужному выводу.
В том же году Даниэль Резерфорд сумел не только получить азот, но и описать его, опубликовать диссертацию и указать основные химические свойства элемента. Но даже Резерфорд так до конца и не понял, что он получил. Однако именно его считают первооткрывателем, потому что он был ближе всех к разгадке.

С греческого "азот" переводится как "безжизненный". Именно Лавуазье трудился над правилами номенклатуры и решил так назвать элемент. В 18 веке про этот элемент было известно лишь то, что он не поддерживает ни реакций горения, ни дыхания. Поэтому данное название приняли.
В латинском языке азот называется "нитрогениум", что в перевод означает "рождающий селитру". Из латинского языка и появилось обозначение азота - буква N. Но само название во многих странах не прижилось.
Азот - это, пожалуй, один из самых распространенных элементов на нашей планете, он занимает четвертое место по распространенности. Элемент также найден в солнечной атмосфере, на планетах Уран и Нептун. Из азота состоят атмосферы Титана, Плутона и Тритона. Помимо этого, атмосфера Земли состоит на 78-79 процентов из этого химического элемента.
Азот играет важную биологическую роль, ведь он необходим для существования растений и животных. Даже тело человека содержит от 2 до 3 процентов этого химического элемента. Входит в состав хлорофилла, аминокислот, белков, нуклеиновых кислот.

Жидкий азот - это бесцветная прозрачная жидкость, является одним из агрегатных состояний химического вещества. Жидкий азот широко используется в промышленности, строительстве и медицине. Он используется при заморозке органических материалов, охлаждения техники, а в медицине для удаления бородавок (эстетическая медицина).
Жидкий азот не токсичен, а также не взрывоопасен.
Молекулярный азот - это элемент, который содержится в атмосфере нашей планеты и образует большую ее часть. Формула молекулярного азота - N2. Такой азот вступает в реакции с другими химическими элементами или веществами только при очень высокой температуре.
При нормальных условиях химический элемент азот - это газ, который не имеет запаха, цвета, а также практически не растворим в воде. Азот жидкий по своей консистенции напоминает воду, такой же прозрачный и бесцветный. У азота есть еще одно агрегатное состояние, при температуре ниже -210 градусов он превращается в твердое тело, образует много больших белоснежных кристаллов. Поглощает кислород из воздуха.
Азот относится к группе неметаллов и перенимает свойства у других химических элементов из этой группы. Как правило, неметаллы не являются хорошими проводниками электричества. Азот образует различные оксиды, например NO (моноокисид). NO или окись азота является мышечным релаксантом (вещество, которое значительно расслабляет мускулатуру и при этом не оказывает никакого вреда и иных влияний на организм человека). Оксиды, где содержится больше атомов азота, например N2O - это веселящий газ, чуть-чуть сладковатый на вкус, который используется в медицине как анестезирующее средство. Однако уже оксид NO2 не имеет никакого отношения к первым двум, ведь это довольно вредный выхлопной газ, который содержится в выхлопах автомобилей и серьезно загрязняет атмосферу.
Азотная кислота, которую образуют атомы водорода, азота и три атома кислорода, является сильной кислотой. Ее широко используют в производстве удобрений, в ювелирном деле, органическом синтезе, военной промышленности (производство взрывчатых веществ, ракетного топлива и синтеза отравляющих веществ), производстве красителей, лекарств и др. Азотная кислота очень вредна для организма человека, на коже оставляет язвы и химические ожоги.
Люди ошибочно полагают, что углекислый газ - это азот. На самом деле, по своим химическим свойствам элемент реагирует лишь с небольшим количеством элементов при нормальных условиях. А углекислый газ - это оксид углерода.

Азот в жидком состоянии применяют в медицине для лечения холодом (криотерапии), а также в кулинарии как хладагент.
Этот элемент также нашел широкое применение в промышленности. Азот - это газ, который взрыво- и пожаробезопасен. Помимо этого, он препятствует гниению и окислению. Сейчас азот используют в шахтах с целью создания взрывобезопасной среды. Газообразный азот применяют в нефтехимии.
В химической промышленности без азота обойтись очень нелегко. Его используют для синтеза различных веществ и соединений, например некоторых удобрений, аммиака, взрывчатых веществ, красителей. Сейчас большое количество азота используют для синтеза аммиака.
В пищевой промышленности это вещество зарегистрировано как пищевая добавка.

Даже ученые первой половины 18 века, которым удалось выделить химический элемент, думали, что азот - это смесь. Но существует большая разница между этими понятиями.
Чистое вещество имеет целый комплекс постоянных свойств, таких как состав, физические и химические свойства. А смесь - это соединение, в которое входит два или больше химических элемента.
Сейчас мы знаем, что азот - это чистое вещество, так как он является химическим элементом.

При изучении химии очень важно понять, что азот является основой всей химии. Он образует различные соединения, которые всем нам встречаются, это и веселящий газ, и бурый газ, и аммиак, и азотная кислота. Недаром химия в школе начинается именно с изучения такого химического элемента, как азот.
fb.ru
Азот – это химический элемент с атомным номером 7. Является газом без запаха, вкуса и цвета. Таким образом, человек не ощущает присутствия азота в земной атмосфере, между тем как она состоит из этого вещества на 78 процентов. Азот относится к самым распространенным веществам на нашей планете. Часто можно слышать, что без азота не было бы жизни на Земле, и это правда. Ведь белковые соединения, из которых состоит все живое, обязательно содержат в себе азот.
Таким образом, человек не ощущает присутствия азота в земной атмосфере, между тем как она состоит из этого вещества на 78 процентов. Азот относится к самым распространенным веществам на нашей планете. Часто можно слышать, что без азота не было бы жизни на Земле, и это правда. Ведь белковые соединения, из которых состоит все живое, обязательно содержат в себе азот.
Азот находится в атмосфере в виде молекул, состоящих из двух атомов. Помимо атмосферы, азот есть в мантии Земли и в гумусном слое почвы. Основной источник азота для промышленного производства – это полезные ископаемые.
Однако в последние десятилетия, когда запасы минералов стали истощаться, возникла острая необходимость выделения азота из воздуха в промышленных масштабах. В настоящее время эта проблема решена, и огромные объемы азота для нужд промышленности добываются из атмосферы.
На Земле азот претерпевает ряд трансформаций, в которых участвуют и биотические (связанные с жизнью) и абиотические факторы. Из атмосферы и почвы азот поступает в растения, причем не напрямую, а через микроорганизмы. Азотфиксирующие бактерии удерживают и перерабатывают азот, превращая его в форму, легко усваиваемую растениями. В организме растений азот переходит в состав сложных соединений, в частности – белков.
По пищевой цепи эти вещества попадают в организмы травоядных, а затем – хищников. После гибели всего живого азот вновь попадает в почву, где подвергается разложению (аммонификации и денитрификации). Азот фиксируется в грунте, минералах, воде, попадает в атмосферу, и круг повторяется.
После открытия азота (это произошло в 18-м столетии), были хорошо изучены свойства самого вещества, его соединений, возможности использования в хозяйстве. Поскольку запасы азота на нашей планете огромны, данный элемент стал использоваться крайне активно. Чистый азот применяется в жидком или газообразном виде. Жидкий азот имеет температуру минус 196 градусов по Цельсию и применяется в следующих областях:
Чистый азот применяется в жидком или газообразном виде. Жидкий азот имеет температуру минус 196 градусов по Цельсию и применяется в следующих областях:
— в медицине. Жидкий азот является хладагентом при процедурах криотерапии, то есть лечения холодом. Мгновенная заморозка применяется для удаления различных новообразований. В жидком азоте хранят образцы тканей и живые клетки (в частности – сперматозоиды и яйцеклетки). Низкая температура позволяет сохранить биоматериал в течение длительного времени, а затем разморозить и использовать.
Возможность хранить в жидком азоте целые живые организмы, а при необходимости размораживать их без всякого вреда высказана писателями-фантастами. Однако в реальности освоить эту технологию пока не удалось;
— в пищевой промышленности жидкий азот используется при розливе жидкостей для создания инертной среды в таре.
Вообще азот применяется в тех областях, где необходима газообразная среда без кислорода, например,
— в пожаротушении. Азот вытесняет кислород, без которого процессы горения не поддерживаются и огонь затухает.
Газообразный азот нашел применение в таких отраслях:
— производство продуктов питания. Азот используется как инертная газовая среда для сохранения свежести продуктов в упаковке;
— в нефтедобывающей промышленности и горном деле. Азотом продувают трубопроводы и резервуары, его нагнетают в шахты для формирования взрывобезопасной газовой среды;
— в самолетостроении азотом накачивают шины шасси.
Все вышесказанное относится к применению чистого азота, но не стоит забывать, что этот элемент является исходным сырьем для производства массы всевозможных соединений:
— аммиак. Чрезвычайно востребованное вещество с содержанием азота. Аммиак идет на производство удобрений, полимеров, соды, азотной кислоты. Сам по себе применяется в медицине, изготовлении холодильной техники;
— азотные удобрения;
— взрывчатые вещества;
— красители и т.д. Азот – не только один из наиболее распространенных химических элементов, но и очень нужный компонент, применяемый во многих отраслях человеческой деятельности.
Азот – не только один из наиболее распространенных химических элементов, но и очень нужный компонент, применяемый во многих отраслях человеческой деятельности.
www.vseznaika.org
Большая часть азота находится в свободном состоянии. Свободный азот является главной составной частью воздуха, который содержит 78,2% (об.) азота. Неорганические соединения азота не встречаются в природе в больших количествах, если не считать натриевую селитру NaNO3, образующую мощные пласты на побережье Тихого океана в Чили. Почва содержит незначительные количества азота, преимущественно в виде солей азотной кислоты. Но в виде сложных органических соединений – белков – азот входит в состав всех живых организмов.
Общее содержание азота в земной коре (включая гидросферу и атмосферу) составляет 0,04% (масс.).
В виде простого вещества азот – это бесцветный газ, не имеющий запаха и весьма мало растворимый в воде. Он немного легче воздуха: масса 1 л азота равна 1,25 г.
Относительной атомной массой элемента называют отношение массы атома данного элемента к 1/12 массы атома углерода. Относительная атомная масса безразмерна и обозначается Ar (индекс «r» — начальная буква английского слова relative, что в переводе означает «относительный»). Относительная атомная масса атомарного азота равна 14,0064 а.е.м.
Массы молекул, также как массы атомов выражаются в атомных единицах массы. Молекулярной массой вещества называется масса молекулы, выраженная в атомных единицах массы. Относительной молекулярной массой вещества называют отношение массы молекулы данного вещества к 1/12 массы атома углерода, масса которого равна 12 а.е.м. Известно, что молекула азота двухатомна – N2. Относительная молекулярная масса молекулы азота будет равна:
Mr(N2) = 14,0064× 2 ≈ 28.
В природе азот существует в виде двух стабильных изотопов 14N (99,635%) и 15N (0,365%). Их массовые числа равны 14 и 15 соответственно. Ядро атома изотопа азота 14N содержит семь протонов и семь нейтронов, а изотопа 15N – такое же количество протонов и шесть нейтронов.
Существует четырнадцать искусственных изотопов азота с массовыми числами от 10-ти до 13-ти и от 16-ти до 25-ти, из которых наиболее стабильным является изотоп 13Nс периодом полураспада равным 10 минут.
На внешнем энергетическом уровне атома азота имеется пять электронов, которые являются валентными:
1s22s22p3.
Схема строения атома азота представлена ниже:
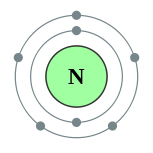
В результате химического взаимодействия азот может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
N0 –5e → N2+;
N0-4e → N4+;
N0-3e → N3+;
N0-2e → N2+;
N0-1e → N1+;
N0+1e → N1-;
N0+2e → N2-;
N0+3e → N3-.
Молекула азота состоит из двух атомов – N2. Приведем некоторые свойства, характеризующие атом и молекулу азота:
|
Энергия ионизации атома, эВ |
14,53 |
|
Сродство атома к электрону, эВ |
0,27 |
|
Относительная электроотрицательность |
3,07 |
|
Радиус атома, нм |
0,071 |
|
Стандартная энтальпия диссоциации молекул при 25oС, кДж/моль |
945 |
ru.solverbook.com
Азот — это химическое соединение. В природе и окружающем нас мире оно достаточно распространено. Например, очень много его содержится в земной коре. Но еще больше в воздухе: он является главной составляющей того, чем мы дышим. Воздух — это смесь азота, кислорода и водорода. Также вещество встречается в воде, в которой мы купаемся, приезжая отдохнуть на речку, озеро или море.
Ни увидеть, ни почувствовать его нельзя. Он не имеет вкуса, цвета и запаха. Тем более, никак нельзя его увидеть в космосе, где он также присутствует в виде облачных следов, остающихся после проносящихся с большой скоростью комет. Много его и вокруг Солнца.

Этот элемент может соединяться с другими химическими элементами. Соединения азота постоянно окружают нас в повседневной жизни, но они не опасны для здоровья человека. Люди ценят его, потому что он содержится в топливе, которое обогревает наши дома, заставляет работать заводы и машины. Нефть очень ценится в любой стране, а в ее состав, между прочим, этот элемент тоже входит.
Да что там говорить, он содержится даже в нас с вами, и в наших домашних животных, и в растениях, которые мама выращивает на подоконнике. Он содержится в организме любого живого существа, поддерживает его жизнь.
Пища, которую мы употребляем, содержит белки, жиры и углеводы. Белки необходимы растущему организму, а в их состав тоже входит азот!
В природе происходит постоянный круговорот веществ. Например, дождь, который выпал на землю и впитался в почву или попал в водоем, впитал в себя многие вещества, встретившиеся на его пути, в том числе и азот в разных соединениях, а потом вдруг выглянуло солнце. Началось испарение воды и с поверхности земли, и из водоемов: в виде газов соединения поднялись в атмосферу, и стали формироваться тучи. Тучи сгущались, гремел гром, и вновь пошел дождь. Разные химические вещества вместе с водой снова вернулись на Землю.
В удобрениях, которые люди используют в садах и огородах, азот содержится обязательно. Именно благодаря ему вырастают такие красивые цветы и такие вкусные ягоды, которыми лакомятся дети, а в магазинах не кончается хлеб, приготовленный из зерновых растений, выращенных на полях.
Данное химическое соединение присутствует в природе в большом количестве, но люди могут производить его самостоятельно в специальных лабораториях, причем как в виде газа, так и в виде жидкости. Хранят его в специальных баллонах черного цвета под давлением.
Если это сообщение тебе пригодилось, буда рада видеть тебя в группе ВКонтакте. А ещё — спасибо, если ты нажмёшь на одну из кнопочек «лайков»:Вы можете оставить комментарий к докладу.
www.doklad-na-temu.ru
Содержание
1. История открытия азота……………………………………………………......2
2. Расположение азота в таблице………………………………………………...3
3. Нахождение азота в природе………………………………………………......3
4. Получение азота……………………………………………………………...4-5
5. Свойства азота……………………………………………………………….....5
5.1 Физические свойства………………………………………........5
5.2 Химические свойства………………………………………........5
6. Применение……………………………………………………………..............6
7. Соединения азота………………………………………………………….…6-7
Литература...............................................................................................................8
В 1777 году Генри Кавендиш провёл следующий опыт: он многократно пропускал воздух над раскалённым углём, затем обрабатывал его щёлочью, в результате получался остаток, который Кавендиш назвал удушливым (или мефитическим) воздухом. С позиций современной химии ясно, что в реакции с раскалённым углём кислород воздуха связывался в углекислый газ, который затем реагировал со щёлочью. При этом остаток газа представлял собой по большей части азот. Таким образом, Кавендиш выделил азот, но не сумел понять, что это новое простое вещество (химический элемент). В том же году Кавендиш сообщил об этом опыте Джозефу Пристли.
Пристли в это время проводил серию экспериментов, в которых также связывал кислород воздуха и удалял полученный углекислый газ, то есть также получал азот, однако, будучи сторонником господствующей в те времена теории флогистона, совершенно неверно истолковал полученные результаты (по его мнению, процесс был противоположным — не кислород удалялся из газовой смеси, а наоборот, в результате обжига воздух насыщался флогистоном; оставшийся воздух (азот) он и назвал насыщенным флогистоном, то есть флогистированным). Очевидно, что и Пристли, хотя и смог выделить азот, не сумел понять сути своего открытия, поэтому и не считается первооткрывателем азота.
Одновременно схожие эксперименты с тем же результатом проводил и Карл Шееле.
В 1772 году азот (под названием «испорченного воздуха») как простое вещество описал Даниэль Резерфорд, он опубликовал магистерскую диссертацию, где указал основные свойства азота (не реагирует со щелочами, не поддерживает горения, непригоден для дыхания). Именно Даниэль Резерфорд и считается первооткрывателем азота.
В дальнейшем азот был изучен Генри Кавендишем (интересен тот факт, что он сумел связать азот с кислородом при помощи разрядов электрического тока, а после поглощения оксидов азота в остатке получил небольшое количество газа, абсолютно инертного, хотя, как и в случае с азотом, не смог понять, что выделил новые химические элементы — инертные газы). Однако и Резерфорд был сторонником флогистонной теории, поэтому также не смог понять, что же он выделил. Таким образом, чётко определить первооткрывателя азота невозможно.
Азо́т — элемент главной подгруппы пятой группы второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 7. Обозначается символом N (лат. Nitrogenium).
Природный азот состоит из двух стабильных изотопов 14N — 99,635 % и 15N — 0,365 %.
Искусственно получены четырнадцать радиоактивных изотопов азота с массовыми числами от 10 до 13 и от 16 до 25. Все они являются очень короткоживущими изотопами. Самый стабильный из них 13N имеет период полураспада 10 мин.
Азот, в форме двухатомных молекул N2 составляет большую часть атмосферы, где его содержание составляет 75,6 % (по массе) или 78,084 % (по объёму).
Азот является элементом, необходимым для существования животных и растений, он входит в состав белков (16—18 % по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. В составе живых клеток по числу атомов азота около 2%, по массовой доле - около 2,5 % (четвертое место после водорода, углерода и кислорода). В связи с этим значительное количество связанного азота содержится в живых организмах, «мёртвой органике» и дисперсном веществе морей и океанов. Это количество оценивается примерно в 1,9×1011 т. В результате процессов гниения и разложения азотсодержащей органики, при условии благоприятных факторов окружающей среды, могут образоваться природные залежи полезных ископаемых, содержащие азот, например, «чилийская селитра» (нитрат натрия с примесями других соединений), норвежская, индийская селитры.
Азот в форме аммиака и соединений аммония, получающийся в процессах биогенной азотфиксации, быстро окисляется до нитратов и нитритов (этот процесс носит название нитрификации). Последние, не связанные тканями растений (и далее по пищевой цепи травоядными и хищниками), недолго остаются в почве. Большинство нитратов и нитритов хорошо растворимы, поэтому они смываются водой и в конце концов попадают в мировой океан (этот поток оценивается в 2,5—8×107 т/год).
В лабораториях его можно получать по реакции разложения нитрита аммония:
Реакция экзотермическая, идёт с выделением 80 ккал (335 кДж), поэтому требуется охлаждение сосуда при её протекании (хотя для начала реакции требуется нагревание нитрита аммония).
Практически эту реакцию выполняют, добавляя по каплям насыщенный раствор нитрита натрия в нагретый насыщенный раствор сульфата аммония, при этом образующийся в результате обменной реакции нитрит аммония мгновенно разлагается.
Выделяющийся при этом газ загрязнён аммиаком, оксидом азота (I) и кислородом, от которых его очищают, последовательно пропуская через растворы серной кислоты, сульфата железа (II) и над раскалённой медью. Затем азот осушают.
Ещё один лабораторный способ получения азота — нагревание смеси дихромата калия и сульфата аммония (в соотношении 2:1 по массе). Реакция идёт по уравнениям:
Самый чистый азот можно получить разложением азидов металлов:
Так называемый «воздушный», или «атмосферный» азот, то есть смесь азота с благородными газами, получают путём реакции воздуха с раскалённым коксом:
При этом получается так называемый «генераторный», или «воздушный», газ — сырьё для химических синтезов и топливо. При необходимости из него можно выделить азот, поглотив монооксид углерода.
Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Этим методом можно получить и «атмосферный азот». Также широко применяются азотные установки, в которых используется метод адсорбционного и мембранного газоразделения.
Один из лабораторных способов — пропускание аммиака над оксидом меди (II) при температуре ~700°С:
Аммиак берут из его насыщенного раствора при нагревании. Количество CuO в 2 раза больше расчётного. Непосредственно перед применением азот очищают от примеси кислорода и аммиака пропусканием над медью и её оксидом (II) (тоже ~700°C), затем сушат концентрированной серной кислотой и сухой щёлочью. Процесс происходит довольно медленно, но он того стоит: газ получается весьма чистый.
При нормальных условиях азот это бесцветный газ, не имеет запаха, мало растворим в воде (2,3 мл/100г при 0 °C, 0,8 мл/100 г при 80 °C), плотность 1,2506 кг/м³ (при н.у.).
В жидком состоянии (темп. кипения -195,8 °C) – бесцветная, подвижная, как вода, жидкость. Плотность жидкого азота 808 кг/м³. При контакте с воздухом поглощает из него кислород.
При -209,86 °C азот переходит в твердое состояние в виде снегоподобной массы или больших белоснежных кристаллов. При контакте с воздухом поглощает из него кислород, при этом плавится, образуя раствор кислорода в азоте.
Азот в свободном состоянии существует в форме двухатомных молекул N2 и соответствует тройной связи между молекулами азота N≡N. Молекула азота неполярна и слабо поляризуется, силы взаимодействия между молекулами очень слабые, поэтому в обычных условиях азот газообразен. Вследствие большой прочности молекулы азота многие его соединения эндотермичны, энтальпия их образования отрицательна, а соединения азота термически малоустойчивы и довольно легко разлагаются при нагревании. Именно поэтому азот на Земле находится по большей части в свободном состоянии.
Ввиду своей значительной инертности азот при обычных условиях реагирует только с литием:
6Li + N2 → 2Li3N,
при нагревании он реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды:
3Mg + N2 → Mg3N2,
Степени окисления азота в соединениях −3, −2, −1, +1, +2, +3, +4, +5.
Жидкий азот применяется как хладагент и для криотерапии.
Промышленные применения газообразного азота обусловлены его инертными свойствами. Газообразный азот пожаро- и взрывобезопасен, препятствует окислению, гниению. В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений. В горнодобывающем деле азот может использоваться для создания в шахтах взрывобезопасной среды, для распирания пластов породы. В производстве электроники азот применяется для продувки областей, не допускающих наличия окисляющего кислорода. Если в процессе, традиционно проходящем с использованием воздуха, окисление или гниение являются негативными факторами — азот может успешно заместить воздух.
Важной областью применения азота является его использование для дальнейшего синтеза самых разнообразных соединений, содержащих азот, таких, как аммиак, азотные удобрения, взрывчатые вещества, красители и т. п. Большие количества азота используются в коксовом производстве («сухое тушение кокса») при выгрузке кокса из коксовых батарей, а также для «передавливания» топлива в ракетах из баков в насосы или двигатели.
В пищевой промышленности азот зарегистрирован в качестве пищевой добавки E941, как газовая среда для упаковки и хранения, хладагент, а жидкий азот применяется при разливе масел и негазированных напитков для создания избыточного давления и инертной среды в мягкой таре [1].
stud24.ru
Азот
Химический элемент
| Символ, номер | N, 7 |
| Атомная масса | 14,00643 а.е.м. |
| Электронная конфигурация | [He] 2s2 2p3 |
| Электроотрицательность | 3,04 по шкале Поллинга |
| Степени окисления | 5; 4; 3; 2; 1; 0; −1; −2; −3 |
| Плотность | 0,001251 г/см³ (при н.у.) |
| Температура плавления | -209,86 °C |
| Температура кипения | -195,75 °C |
| Структура кристаллической решетки | кубическая |
| Теплопроводность | (300 K) 0,026 Вт/(м·К) |
Азот — весьма инертный химический элемент.
В работе «Химический трактат о воздухе и огне» шведский химик К. Шееле описал получение и свойства «огненного воздуха» и отметил, что атмосферный воздух состоит из двух «видов воздуха»: «огненного» — кислорода и «флогистованого» — азота. Однако приоритет открытия кислорода принадлежит Джозефу Пристли, потому что труд Шееле был опубликован только в 1777 году.
В 1772 году азот (под названием «испорченного воздуха») как простое вещество описал Даниэль Резерфорд, он опубликовал магистерскую диссертацию, где указал основные свойства азота (не реагирует со щелочами, не поддерживает горения, непригоден для дыхания). Именно Даниэль Резерфорд и считается первооткрывателем азота.
Название «азот» (от греч. ἀζωτος — безжизненный, (на других языках: лат. Nitrogenium — то, что порождает селитру) предложено в 1787 Антуан Лавуазье, который в то время в составе группы других французских ученых разрабатывал принципы химической номенклатуры.
Общее содержание азота в земной коре составляет 1 · 10−2 % по массе. Основная его масса находится в воздухе. Сухой воздух содержит в среднем 78,09 % по объему (или 75,6 % по массе) свободного азота, соответствует общей массе 4 • 1015 т.[1] В отношении малых количествах свободный азот находится в растворенном состоянии в водах океанов. В виде соединений с другими элементами (связанный азот) входит в состав всех растительных и животных организмов. Мощные месторождения азота в виде так называемой чилийской селитры известны лишь в Чили (Южная Америка). Кроме того, небольшие количества азота содержатся в почве, главным образом в виде органических соединений и солей азотной кислоты.
Азот имеет два стабильных изотопа: 14N (99,63 %) и 15N (0,37 %). Искусственно получено 4 радиоактивных изотопа азота с массовыми числами 12, 13, 16, 17.
Азот входит в главной подгруппы пятой группы периодической системы Менделеева. Порядковый номер его 7. Атомы азота имеют во внешней электронной оболочке пять электронов. Поэтому они могут присоединять три электрона, которых им не хватает для образования полностью заполненной восемью электронами оболочки, и восстанавливаться до ионов N 3 или терять пять валентных электронов, превращаясь в положительно заряженные ионы и проявляя при этом свою максимальную положительную валентность. Атомы азота также могут терять и меньшее количество электронов, проявляя при этом положительную валентность 1+, 2+, 3+ и 4+.
Молекулы азота двухатомные, оба атома прочно связаны между собой тремя общими электронными парами.
Чтобы разложить молекулу азота на атомы, надо потратить значительное количество энергии. Поэтому азот при обычных условиях химически довольно пассивный.
При высоких температурах, когда молекулы азота разлагаются и он переходит в атомарное состояние, он сравнительно легко вступает в реакции с металлами (особенно с активными), образуя так называемые нитриды. При высокой температуре, высоком давлении и наличии катализатора оксид соединяется с водородом с образованием аммиака. При температуре электрической искры (свыше 3000 °C) азот реагирует с кислородом, образуя неустойчивый при высокой температуре монооксид азота NO по реакции:
В природе эта реакция происходит при грозовых разрядах.
В обычных условиях азот физиологически инертен, но при вдыхании сжатого воздуха наступает состояние, называемое азотным наркозом, подобное алкогольному опьянению. Эти случаи могут быть при условии водолазных работ на глубине нескольких десятков метров. Для предупреждения возникновения данного состояния порой пользуются искусственными газовыми смесями, в которых азот заменен гелием или иным инертным газом. При резком и значительном снижении парциального давления азота, растворимость его в крови и тканях настолько уменьшается, что часть его выделяется в виде пузырьков, является одной из причин возникновения кессонной болезни, которая наблюдается у водолазов при быстром их поднятии на поверхность и у пилотов при больших скоростях взлета самолета, а также при входе в верхние слои атмосферы.
В смеси с кислородом азот используется как слабый наркотик, вызывающий состояние опьянения, эйфории, притупление болевой чувствительности. Используется для ингаляционного наркоза.
Получение азота разложением нитрита аммонияВ лабораторных условиях чистый азот обычно получают путем разложения при нагревании раствора нитрита аммония по реакции:
Еще один из лабораторных способов — пропускание аммиака над оксидом меди (II) при температуре 700 °C:
Аммиак берут из насыщенного раствора при нагревании, количество CuO в 2 раза больше расчетного. Непосредственно перед применением азот очищают от примесей кислорода и аммиака пропусканием над медью и ее оксидом (II), затем сушат концентрированной серной кислотой и сухой щелочью. Процесс достаточно медленный, но газ получается довольно чистый.
В промышленности азот в больших количествах добывают из воздуха с помощью азотных станций.
Жидкий азотЖидкий азот применяется как хладагент и для криотерапии.
Промышленное применение газообразного азота обусловлены его инертными свойствами. Газообразный азот пожаро- и взрывобезопасный, препятствует окислению, гниению. В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличение выработки месторождений. В горном деле азот может использоваться для создания в шахтах взрывобезопасной среды, для распирания пластов породы. В производстве электроники азот применяется для продувки областей, не допускающих наличия кислорода. Если в процессе, традиционно проходит с использованием воздуха, окисления или гниения являются негативными факторами — азот может успешно заменить воздух.
Большая часть получаемого в технике азота используется для производства аммиака.
В последнее время значительное распространение получило использование азота для создания инертной среды при проведении некоторых химических реакций, при перекачке горючих жидкостей и т. д.
Поскольку азот имеет низкую температуру кипения (77,4 К), то сжиженный азот является одним из главных криогенных жидостей.
Азот присутствует во многих взрывчатых веществах. Их свойства объясняются тем, что образование молекулы азота приводит к установлению очень прочной тройной связи, при этом высвобождается большое количество энергии.
cyclowiki.org

Разделы: Химия
Цели:
Оборудование и реактивы:проектор, компьютер, Презентация, рабочая тетрадь (Приложение 1), дихромат аммония, серная кислота, стеклянная палочка, асбестовая сетка, спиртовка.
Методы: словесно-наглядный.
Методика:традиционный урок, изучение нового.
ХОД УРОКА
– Здравствуйте, ребята! У вас на столах находятся листы, которые сегодня будут служить рабочей тетрадью. В них представлены задания разного плана и характера. И в течение урока вы будете вписывать туда ответы.
(Презентация, слайд 1)
– А нам, друзья, не должно быть всё равно. Ведь мы живём в таком мире, в котором много тайн, загадок, неизведанных фактов. Сегодня мы переходим к изучению следующей подгруппы элементов – это подгруппа азота. И познакомимся с одним из удивительных веществ, с таким знакомым и таким неизведанным, как азот. Тема урока у вас уже представлена в рабочей тетради (Приложение 1).
(Слайд 2)
Характеризовать азот будем по следующему плану:
(Слайды 3,4)
I. История открытия азота
Откройте 2 лист. Вам необходимо будет в течение моего рассказа кратко вписать в пустые строки открытия учёных. В 1756 г. англичанин Даниэль Резерфорд установил, что воздух, оставшийся под колоколом, где жила несколько дней мышь, освобожденный от углекислого газа, не поддерживает горение и дыхания. Этот газ он назвал «ядовитым воздухом». В 1773 г. Карл Шееле – шведский аптекарь – установил, что воздух состоит из двух газов. Газ, не поддерживающий горение и дыхание, он назвал «испорченным воздухом». В 1776 г. известный французский учёный Антуан Лавуазье, подробно исследуя «ядовитый» и «испорченный» воздухи, установил, что это одно и то же вещество, и предложил назвать его азотом.
(Слайд 5)
Азот в переводе с греческого означает безжизненный (от лат. а – нет и зоэ – жизнь). Так ли это? Узнаем, изучив более подробно азот и его свойства.? Охарактеризуйте положение азота в ПС Д.И. Менделеева. Азот находится во 2 периоде, V группе, главной подгруппе.
(Слайд 6)
II. Строение атома и молекулы азота
1. Строение атома азота
Азот находится в V группе в главной подгруппе во 2 периоде.? Сколько энергетических уровней в атоме азота? Пользуясь этой информацией изобразите строение атома азота, вписав нужное количество протонов, нейтронов и электронов. Сверим ваши решения.
Далее нам необходимо заполнить таблицу. Зарисуем строение внешнего электронного слоя.
? Сколько электронов на внешнем энергетическом уровне?? Каково максимальное количество электронов на внешнем энергетическом уровне?? Сколько электронов может присоединить атом азота? Вследствие этого он приобретёт степень окисления – 3. Атомы азота могут также отдавать свои внешние электроны более электроотрицательным элементам.? Каким, например? Атомы азота приобретают при этом степень окисления +3 и +5. Атомы азота проявляют восстановительные свойства и в степенях окисления +1, +2, +4, но соединения с такими элементами встречаются редко. Летучее водородное соединение Nh4 – аммиак. Высший оксид – N3O5 – оксид азота (V). Кислота – HNO3 – азотная кислота. Рассмотрим свойства атома азота. Впишите соответствующее количество электронов в схемы. В первом случае азот – восстановитель, во втором – окислитель.
2. Строение молекулы азота
В свободном состоянии азот существует в виде двухатомных молекул N2. У атома азота на внешнем слое 5 электронов: 2 спаренных и 3 неспаренных. В образовании тройной связи в молекуле азота участвуют неспаренные электроны. В этих молекулах два атома азота связаны очень прочной тройной связью. Даже при t ≈ 3300oC только одна из тысячи молекул азота распадается на атомы. Молекула азота устойчива, инертна.
(Слайд 7)
Выполним задание 1.
(Слайд 8)
III. Свойства азота
Перевернули на 3 лист.
1. Физические свойства
Охарактеризуем физические свойства азота, выполнив задание 2. Вам необходимо прочитать §24, с. 143 второй абзац и вписать ответы.Азот – бесцветный газ без запаха и вкуса. В воде растворяется хуже кислорода. Азот в твёрдом состоянии имеет молекулярную кристаллическую решётку, поэтому у него низкие температуры плавления и кипения.ρ = 0,81 г/см3 (N2 – жидкий)tпл. = – 210oСtкип. = – 195,8oС
(Слайд 9)
На этом слайде вы видите жидкий азот. В молекуле азота атомы соединены прочной тройной связью.? Как вы думаете, будет ли азот активен в химических реакциях? Прочностью молекулы азота обусловлена его химическая инертность.
2. Химические свойства
И мы с вами перемещаемся в лабораторию химика. Это задание 3.
(Слайд 10)
При обычных условиях азот взаимодействует только с литием.
При этом образуется нитрид лития Li3N. При нагревании азот образует нитриды с рядом других металлов, например:
Азот в соединениях с металлами проявляет степень окисления = –3.
Попытайтесь составить уравнение химической реакции взаимодействия азота с алюминием. Проверим.
Уравнение химической реакции взаимодействие азота с кальцием допишите дома.
При высоких температурах, давлении и в присутствии катализатора азот реагирует с водородом, образуя летучее водородное соединение – аммиак. Закончите это уравнение реакции.
Что записали? При температуре электрической дуги азот реагирует с кислородом в результате образуется оксид азота (II). Запишите.
Что получилось в итоге?
(Слайд 11)
В природе подобный процесс наблюдается при грозах. Вы видите при каких трудных условиях протекают эти реакции, а это связано с особенностями строения молекулы азота, с наличием тройной связи.
(Слайд 12)
Рассмотрим 2 последние реакции. Задание 4. Реакция взаимодействия азота с кислородом. Охарактеризуем её, выбрав соответствующую характеристику из рамки посередине. Во-первых, это реакция соединения, некаталитическая, протекает с поглощением теплоты, то есть эндотермическая.
? Охарактеризуйте реакцию взаимодействия азота с водородом по тем же критериям.
Проверим. Мы рассмотрели строение и свойства азота. А как его получают – рассмотрим. Перевернули лист на следующую страницу.
IV. Получение и применение азота
1. Получение азота
(Слайд 13)
В промышленности азот получают перегонкой жидкого воздуха. В промышленности азот получают из воздуха, используя различия в температурах кипения азота и кислорода. В лаборатории азот получают разложением неустойчивых соединений азота. Также его можно получить разложением дихромата аммония.(Демонстрация опыта). А для чего он необходим, какова его роль.
2. Применение азота
(Слайд 14)
Глядя на рисунок в ваших листах, выполните задание 5, составив связный рассказ о применении азота. Азот широко применяют в химической промышленности для получения аммиака, мочевины и других химикатов. В электротехнике он используется как инертная среда для заполнения электрических лампочек. Жидкий азот применяют в охладительных системах.
(Слайд 15)
Но какова биологическая роль азота? Нужен ли он человеку?
V. Круговорот азота в природе
Атмосфера на 78% состоит из азота, на 21% – из кислорода. Оставшийся 1% занимают другие газы. Атмосферный воздух является неисчерпаемым резервуаром. Однако основная часть живых организмов не может непосредственно использовать этот азот. Он должен быть предварительно связан в виде химических соединений. Для усвоения азота растениями необходимо, чтобы он входил в состав ионов аммония Nh5+ или нитрата NO3–. Такие растения, как мышиный горошек, люпин, люцерна, клевер способны усваивать атмосферный азот. Некоторое количество азота переводится в связанное состояние во время грозы. Вы удивитесь, но вспышки молний происходят гораздо чаще, чем вы думаете, – порядка ста молний каждую секунду. Пока я проговорила это предложение, во всем мире сверкнуло примерно 500 молний. Образовавшийся оксид азота выпадает с дождями на поверхность почвы. Кроме того, различные химические предприятия собирают азот из воздуха. В почве происходят процессы, в результате которых образуются нитраты NO3–, которые легко усваиваются корнями растений. Давайте ответим на вопрос, поставленный в начале урока. Такой ли безжизненный азот?
Азот – безжизненный газ. И что он значит для нас? Какой для него закон? Рассмотрим с разных сторон: Азот – неживой, без сомненья Не знает дыханья, горенья… А, если, с другой стороны – Иные аспекты видны: Он входит в состав белков – Для вечной жизни готов И к нужной, полезной работе – Участвует в круговороте… Немного о нём мы знаем, Но тайну приоткрываем. И новые знания ждут, Всех тех, кто дальше пойдут! Открытий великих ряд И вам любопытный взгляд, И опытов тесный круг Для царства одной из наук! А химия как чаровница, Как чудо, которое длится.
– Итак, подведём итоги урока. (Выставляю отметки).
Домашнее задание: §24 «Азот». Составить рассказ на тему: «Путешествие азота в природе».
Задание: Для перевозки овощей и фруктов на дальние расстояния используют рефрижераторы, в которых в качестве хладоагента используют жидкий азот. На каких свойствах это основано?
xn--i1abbnckbmcl9fb.xn--p1ai