
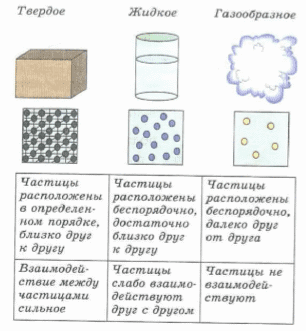
На рисунках атомы изображены кружочками. В будущем вы узнаете, что строение атомов более сложное.
Молекулы, атомы и ионы настолько малы, что невооруженным глазом увидеть их невозможно. Например, в головке простой булавки находится столько частиц, что если взять столько же яблок, то из них сложится высокая гора.
Мельчайшие частицы любого вещества, будь то газ, жидкость или твердое тело, находятся в постоянном беспорядочном движении. Причем чем быстрее движутся частицы, тем выше температура вещества. Правильность этого предположения подтверждает ряд явлений. Одно из них — диффузия — явление, когда вещества смешиваются сами собой.
Диффузия в газах происходит быстрее, чем в жидкостях, а в жидкостях быстрее, чем в твердых телах. Это связано с тем, что частицы твердых тел расположены почти вплотную друг к другу. Между частицами жидкостей есть промежутки. А молекулы газа вообще далеко расположены друг от друга. Диффузия при более высокой температуре происходит быстрее.
Это и понятно: чем выше температура, тем быстрее движутся частицы вещества.
Любое вещество состоит из мельчайших частиц, расположенных на некотором расстоянии друг от друга. Почему же частицы твердого вещества и жидкости не разлетаются? Опыт показывает: если опустить на поверхность воды стекло, подвешенное на нитках, а затем попробовать его поднять, потребуется значительное усилие. Дело в том, что частицы воды и стекла притягиваются друг к другу.
Если растянуть пружину, а потом отпустить, то ее частицы, притягиваясь друг к другу, заставят пружину принять свои прежние размеры.

Если поверхности свинцовых цилиндров отполированы, то частицы поверхностного слоя одного цилиндра могут оказаться на достаточно близком расстоянии от частиц другого цилиндра и будут притягиваться друг к другу·
Тогда возникает вопрос: «Если частицы притягиваются, то почему они не сближаются вплотную?»
Оказывается, между частицами действуют еще и силы отталкивания.
Если пружину сжать, то она расправится: частицы, которые подошли слишком близко друг к другу, отталкиваются.
Частицы любого вещества находятся на некотором расстоянии друг от друга и взаимодействуют , т. е. притягиваются и отталкиваются.
Из описанных выше и проделанных вами опытов следует вывод:
взаимное расположение частиц в вещ ест вах бывает различным в зависимости от состояния вещества.
estvo.blogspot.com
Раздел 2. СТРОЕНИЕ ВЕЩЕСТВА
§8. АТОМЫ И МОЛЕКУЛЫ
3. РАЗМЕРЫ МОЛЕКУЛ И АТОМОВ
ПРОВЕДЕМ ОПЫТ
Капнемо на поверхность спокойной воды капельку масла (лучше взять оливковое масло). Масло растечется по поверхности воды очень тонким слоем. Однако толщина масляной пленки не может быть меньше размера молекулы масла, что и определяет максимальную площадь пленки (рис. 8.7). Так, опыты показывают, что капелька оливкового масла объемом 1 мм3 растекается пятном, площадь которого не превышает 1 м2.
Зная объем капли и площадь масляной пленки, можно оценить длину молекулы масла (эти молекулы имеют удлиненную форму и расположены на поверхности воды перпендикулярно к поверхности). Если из капельки объемом 1 мм3 образуется масляная пленка площадью 1 м2, то толщина пленки, равная примерно длине молекулы масла, составляет около 1 нанометра (нм), т. е. одной миллиардной доли метра! Примите во внимание, что молекула масла состоит из многих атомов!
Самая маленькая молекула — молекула одноатомна гелия (около 0,2 нм). Размер молекулы воды состоит из двух атомов Гідроґену и одного атома Оксиґену, немного больше: около 0,3 нм.
Итак, характерной длиной в мире атомов и молекул является 0,1 нм.
Чтобы вы смогли представить размеры молекул, приведем такие сравнения.
1. В одной чайной ложке воды примерно столько же молекул воды, сколько чайных ложек воды в Мировом океане (во всех морях и океанах Земли вместе взятых). То есть, чтобы пересчитать молекулы воды в чайной ложке, нужно столько же времени, сколько для того, чтобы вычерпать чайной ложечкой весь Мировой океан!
2. Атом Гідроґену примерно в столько раз меньше сливы, во сколько раз сама слива меньше земного
шара. Представьте себе, что огромная Земля состоит вся из слив, — и вы представите, как сама слива состоит из атомов!
«ЖИВЫЕ» МОЛЕКУЛЫ
Все живые существа состоят из огромных, чрезвычайно сложно построенных молекул.
Например, в каждом существе есть особые молекулы, в которых последовательностью атомов «записано» всю так называемую «наследственную информацию» — подобно тому, как в книге буквами набран текст.
Только благодаря невероятно тонкой и точной «работе» таких молекул ребенок похож на своих родителей: котенок — в кошку, а слоненок — слон.
Модель короткого фрагмента такой «наследственной молекулы показано на рис. 8.8. Эти молекулы свернуты в длинные спирали. Чтобы дать вам представление о количестве и длину этих молекул, скажем только, что если бы «наследственные молекулы, которые содержатся в организме одного человека, выстроить в один ряд, то их общая длина была бы в сто раз больше расстояния от Земли до Солнца!
Молекулы, из которых состоят живые существа, часто называют биологическими. Строение и взаимодействие биологических молекул напоминают строение и работу сложных механизмов. Для изучения структуры и действия биологических молекул физика и биология, объединившись, породили новую науку — биофизику. Эта наука изучает строение живых организмов, используя методы не только физики и биологии, но и других наук, например химии и информатики.
ДЕЙСТВИТЕЛЬНО ЛИ АТОМ является НЕДЕЛИМЫМ?
В начале 20-го века ученые смогли проникнуть и внутрь атома.
Английский ученый Эрнест Резерфорд, «обстреливая» атомы пучками быстрых частиц, установил, что некоторые из этих частиц вследствие столкновения с атомами «отскакивают» обратно! Объяснить это можно было только тем, что внутри атома есть крошечное ядро, в котором сосредоточено практически всю массу атома.
Расчеты, сделанные Резерфордом, показали, что размеры ядра примерно в сто тысяч раз меньше размеров атома. То есть, если атом увеличить до размеров цирковой арены, то ядро было бы «маковым зернышком» посередине арены!
Поэтому Демокрит, который утверждал, что в природе есть только атомы и пустота, недооценил «роль» пустоты: оказалось, что и атомы «наполнены» преимущественно пустотой!
Ядро имеет положительный электрический заряд, а вокруг ядра движутся очень легкие отрицательно заряженные частицы — электроны. Это напоминает Солнечную систему. Сходство атома до Солнечной системы усиливается и тем, что почти вся масса Солнечной системы сосредоточена в Солнце: масса всех планет, вместе взятых, составляет около одной тысячной доли массы Солнца.
Исходя из этого, Резерфорд предложил «планетарную» модель атома, согласно которой электроны в атоме движутся вокруг атомного ядра подобно тому, как планеты движутся вокруг Солнца. Однако вскоре выяснилось, что движение электронов происходит совсем по другим законам, чем движение планет. Подробнее вы узнаете об этом из курса физики следующих классов.
Итак, оказалось, что атом есть подільним: он состоит из атомного ядра и электронов. Сразу же возник вопрос: а является неделимым атомное ядро?
В дальнейших опытах (в частности, проведенных тем же Резерфордом) выяснилось, что ядро атома состоит из частиц двух типов: положительно заряженных протонов и нейтронов, которые не имеют электронного заряда.
Массы протона и нейтрона оказались примерно одинаковыми. Это объяснило, почему массы всех атомов примерно кратны массе атома Гідроґену: ядро атома Гідроґену состоит из одного протона, а ядра всех других атомов построены из частиц примерно одинаковой массы, как из одинаковых «кирпичиков».
На рис. 8.9 схематически изображено строение простейших атомов — атомов Гідроґену, Гелия и Лития.
Однако на этом путешествие «внутрь материи» не остановилась: во второй половине 20-го века ученые открыли, что протон и нейтрон — также составные частицы! Подробнее об этом вы тоже узнаете из курса физики следующих классов.
schooled.ru

Разделы: Химия
Цель урока: формирование понятия молекула, атомом, химический элемент.
Задачи урока:
ОУУН:
Оборудование:
Тип урока: комбинированный.
Методы: проблемное изложение материала.
Формы: групповая, парная, индивидуальная.
Ожидаемые результаты:
Структура урока:
Ход урока
1. Организационный момент.
2. Актуализация знаний учащихся.
В 5-м классе на уроках природоведения вы рассматривали понятие атом и молекула. Что это такое? (Учащиеся дают определение, которое помнят с уроков природоведения).
Люди давно догадывались о том, что вещества состоят из отдельных мельчайших частиц. Их называют атомами. Во многих случаях атомы не существуют по одиночке, а объединяются в группы – молекулы. Атомы и молекулы чрезвычайно малы: в любом крошечном кусочке вещества, который мы в состоянии разглядеть (например, в пылинке) содержится больше атомов, чем звезд во всей нашей Галактике.
Осознать значение числа радиуса атомного ядра очень сложно. Например, радиус атома углерода равен 1,5–10 м. Возьмите карандаш (графит – это углерод), проведите отрезок прямой линии длиной 3 см. (Учащиеся проводят линию).
Как вы думаете, сколько атомов углерода содержится в проведенной вами линии?
Учащиеся дают свои ответы.
Полученная линия содержит 100 мл атомов углерода в длину и около 1 мл в ширину.
Рассмотрим пример с сахаром: Какими свойствами обладает сахар? (Учащиеся отвечают: растворяется в воде, сладкий, белый). Представим, что крупинки сахара это молекулы. Раздробим молекулы до атомов, (учитель растирает сахар в ступке, ученик по желанию ему помогает). А сейчас смотрим, мы размельчили наши «молекулы», свойства сахара изменились? (Учащиеся отвечают, что нет). Какой вывод мы можем сделать? (Учащиеся отвечают, что свойства при измельчение не изменяются).
Какое определение вы дадите молекуле и атому? С химической точки зрения.
Дети дают определения, потом записывают их в тетрадь: молекула - это наименьшая частица вещества, определяющая его свойства и способная к самостоятельному существованию; молекулы построены из атомов; атом – это мельчайшая неделимая частица вещества, являющаяся носителем его свойств.
3. Изучение новой темы.
Слайд 1 (приложение 1).
На следующем слайде мы видим, что молекула воды состоит из атомов двух видов. Это атомы водорода и кислорода.
Рассмотрев изображение модели молекулы воды, какой мы можем сделать вывод?
Учащиеся отвечают, что вода состоит из двух атомов водорода и одного атома кислорода.
Слайды 2, 3 (приложение 1, портреты Роберт Бойль, Джон Дальтон).
В конце 17 столетия английский ученый Роберт Бойль впервые использовал в науке понятие о химическом элементе как составной части вещества. Он считал химический элемент – это вещество, которое нельзя разложить на более простые. Более чем через 100 лет другой английский ученый – Джон Дальтон связал понятие о химическом элементе с атомной гипотезой о строении вещества. Определение, которое дал Дальтон, химики используют и в наши дни.
Химический элемент – это совокупность атомов определенного вида. (Дети записывают определение).
В природе найдено 89 различных химических элементов. Достижения ядерной физики позволили получить ряд элементов искусственным путем. Поэтому в настоящее время изучено более 110 химических элементов. Каждый химический элемент имеет условное обозначение – химический знак или символ, название. А сейчас мы прослушаем домашнее задание.
Презентация домашнего задания «Химические элементы в древности», (приложение 2).
Задание: "Придумайте такие обозначения для химических элементов, чтобы их легко было воспроизвести. Какими ассоциациями Вы пользовались?" Когда большая часть учащихся выполнит это задание в тетради, следует попросить двух – трех учеников записать изобретенные ими символы на доске рядом с алхимическими. (Сравнение записанных на доске символов приводит к идее унификации способов обозначения химических элементов. Эту задачу успешно решил шведский естествоиспытатель Й. Я. Берцелиус).
Учащиеся задают вопросы.
В 1813 году Берцелиус предложил для обозначения химических элементов использовать буквы латинского алфавита. Система Берцелиуса очень проста. Химический элемент обозначают первой буквой латинского названия элемента. В некоторых случаях к первой букве добавляют еще букву с середины названия. Разработанными им знаками мы пользуемся до сих пор. Знаки химических элементов читаются по определенным правилам. Некоторые знаки читаются как буквы латинского алфавита. Исключение Н, который читают как букву Франц. алфавита.
Предложение Берцелиуса было принято всеми учеными, так как такие символы оказались очень удобным: их легко написать в тетради и напечатать в книге, они понятны каждому образованному человеку, независимо от того, на каком языке он говорит. Знаки 10 элементов читают как латинское название этих элементов. Знаки остальных элементов читаются как русские названия.
Слайд 4 (приложение 1).
Для обозначения химических элементов используют одинаковые знаки во всех странах мира. Знаки химических элементов вы можете найти во всех блицах периодической системы разных стран.
Слайды 5, 6, 7 (приложение 1).
Ребята обратите внимание: калий и кальций, в название кальция есть буква «цэ», с которой и начинается написание знака, в название калия ее нет. Магний и марганец. Натрий и азот. (Обратить внимание на эти знаки их некоторые учащиеся путают)
Презентация домашнего задания «Биография химических элементов» (приложение 3).
Презентация домашнего задания «Происхождение названий химических элементов» (приложение 4)
Вопрос: Ученые древних времен считали, что как слова состоят из букв, так и вещества состоят из элементов. Даже великий французский химик Лавуазье принимал термины элемент и простое вещество как равнозначные. Только Менделеев начал различать эти понятия. Что же такое химический элемент и простое вещество? (химический элемент – это один атом или их совокупность. Простое вещество – форма существования конкретного химического элемента. (Углерод – элемент, уголь, алмаз – простые тела).
Давайте подведем итог урока, что нового вы узнали сегодня на уроке?
Учащиеся отвечают.
4. Систем. Закрепление.
А сейчас ребята проверим, как вы усвоили материал.
Проверочная работа в форме егэ.
Учащиеся выполняют работу по карточкам (см. приложение 5).
5. Итог.
Итоги урока: выставление оценок. Домашнее задание.
xn--i1abbnckbmcl9fb.xn--p1ai
Гипотеза о том, что все вещества состоят из отдельных мельчайших частиц, появилась очень давно, более двух тысяч лет назад. Но лишь на рубеже XIX — XX вв. было установлено, что это за частицы и какими свойствами они обладают.
Частицы, из которых состоят вещества, называют молекулами. Так, например, наименьшая частица воды — это молекула воды, наименьшая частица сахара — это молекула сахара и т. д.
Каковы размеры молекул?
Известно, что кусок сахара можно растолочь на очень маленькие крупинки, зерно пшеницы можно размолоть в муку. Капля масла, растекаясь по поверхности воды, может образовать пленку, толщина которой в десятки тысяч раз меньше диаметра человеческого волоса. Но в крупинке муки и в толще масляной пленки содержится не одна, а много молекул. Значит, размеры молекул этих веществ еще меньше, чем размеры крупинки муки и толщина пленки.
Можно привести следующее сравнение: молекула во столько же раз меньше яблока среднего размера, во сколько раз яблоко меньше земного шара. Если бы размеры всех тел увеличились в миллион раз (при этом толщина человеческого пальца стала бы равной 10 км), то и тогда молекула оказалась бы размером всего вполовину точки печатного шрифта этого учебника.
Молекулы невозможно увидеть невооруженным глазом. Они настолько малы, что их нельзя разглядеть даже с помощью микроскопа, дающего 1000-кратное увеличение.
Биологам известны микроорганизмы (например, бактерии) размером 0,001 мм. Молекулы же в сотни и тысячи раз меньше.
Для определения размеров молекул были проведены разные опыты. Опишем один из них.
В чисто вымытый большой сосуд налили воду и на ее поверхность поместили каплю масла. Масло начало растекаться по поверхности воды, образуя пленку. По мере растекания масла толщина пленки становилась все меньше и меньше. Через некоторое время растекание прекратилось. Если предположить, что это произошло из-за того, что все молекулы масла оказались на поверхности воды (образуя пленку толщиной в одну молекулу), то для определения диаметра молекулы достаточно найти толщину образовавшейся пленки.
Толщина пленки h равна отношению ее объема V к площади S:
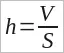 (26.1)
(26.1)
Объем пленки — это объем той капли, которую поместили на поверхность воды. Его измеряют заранее; для этого пользуются измерительным цилиндром — мензуркой. При помощи пипетки в пустую мензурку капают несколько десятков капель масла и измеряют их общий объем; разделив затем этот объем на число капель, находят объем одной капли.
В описываемом опыте капля имела объем V = 0,0009 см3, а площадь образовавшейся из нее пленки была равна S = 5500 см2. Подставив эти значения в формулу (26.1), получим
h = 0,00000016 см.
Этим числом и выражается примерный размер молекулы масла.
Так как молекулы очень малы, то в каждом теле их содержится огромное количество. Чтобы создать представление об их числе, приведем пример: если в детском резиновом шарике, наполненном водородом, сделать такой тонкий прокол, что из него каждую секунду будет выходить по миллиону молекул, то для вылета всех молекул из шарика понадобится 30 миллиардов лет! И это при том, что масса водорода, наполнявшего шарик, составляла всего 3 г.
Хотя молекулы и очень маленькие частицы, но и они делимы. Частицы, из которых состоят молекулы, называют атомами.
Атомы каждого вида принято обозначать специальными символами. Например:
атом кислорода — О,атом водорода — Н,атом углерода — С.
Специальные символы (так называемые химические формулы) существуют и для обозначения молекул. Например, молекула кислорода состоит из двух одинаковых атомов кислорода, поэтому для ее обозначения применяют следующую химическую формулу: O2. Молекула воды состоит из трех атомов: одного атома кислорода и двух атомов водорода, поэтому ее обозначают h3O.
На рисунке 68 дано условное изображение двух молекул воды. При делении двух молекул воды получаются два атома кислорода и четыре атома водорода. Каждые два атома водорода могут объединиться в молекулу водорода, а атомы кислорода — в молекулу кислорода, что схематически показано на рисунке 69. Современная техника позволяет получить фотографии отдельных атомов и молекул. На рисунке 70 приведен снимок молекулы фторида мышьяка, полученный с помощью электронно-голографического микроскопа, дающего увеличение в 70 миллионов раз. Фотографию отдельного атома можно увидеть на рисунке 71, это изображение атома аргона, увеличенное в 260 миллионов раз.
Современная техника позволяет получить фотографии отдельных атомов и молекул. На рисунке 70 приведен снимок молекулы фторида мышьяка, полученный с помощью электронно-голографического микроскопа, дающего увеличение в 70 миллионов раз. Фотографию отдельного атома можно увидеть на рисунке 71, это изображение атома аргона, увеличенное в 260 миллионов раз.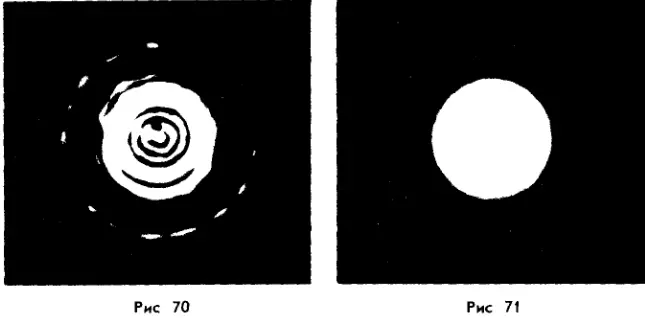 Атомы очень маленькие частицы, но и они имеют сложное строение. Существуют еще более мелкие частицы, о которых вы узнаете позже.
Атомы очень маленькие частицы, но и они имеют сложное строение. Существуют еще более мелкие частицы, о которых вы узнаете позже.
1. Как называются частицы, из которых состоят вещества? 2. Опишите опыт, с помощью которого можно определить размер молекулы. 3. Как называются частицы, из которых состоят молекулы? 4. Из каких атомов состоит молекула воды? Что означает формула Н2О? 5. Напишите химическую формулу молекулы водорода, если известно, что эта молекула состоит из двух одинаковых атомов водорода. 6. Из скольких (и каких) атомов состоит молекула углекислого газа, если ее химическая формула имеет вид СO2?
phscs.ru

Молекулы и атомыСлайд-презентация учителя физики Частной школы «Исток» Юлдашевой М.В.

Демокритсчитал, что все тела состоят из бесчисленного количества сверхмалых, невидимых глазу, неделимых частиц.

Четыре элемента физического мира - огонь, воздух, вода и земля - состоят из атомов. Только атомам огня Демокрит приписывал определенную форму - шарообразную, об остальных трех элементах известно, что у них форма одинаковая, но величина разная: самые большие атомы земли, самые мелкие у воздуха. Все вещества состоят из отдельных мельчайших частиц : молекул и атомов.

Замечательная догадка Демокрита, родившегося 24 века назад, была, к сожалению, надолго забыта.

Ломоносов М .В.Ввёл в науку понятие «молекула» (мельчайшая). Это понятие физики оставляли без внимания ещё 100 лет.



Titan3 FEIодин из наиболее совершенных в настоящее время просвечивающих электронных микроскопов. Его высота – около 3 м, масса – порядка 3,5 т, цена – около 5 млн. евро. Благодаря наличию компьютеризованной системы установки и позиционирования образцов он способен работать сутками без вмешательства оператора, генерируя поток данных объемом около 1 ГБ/с.
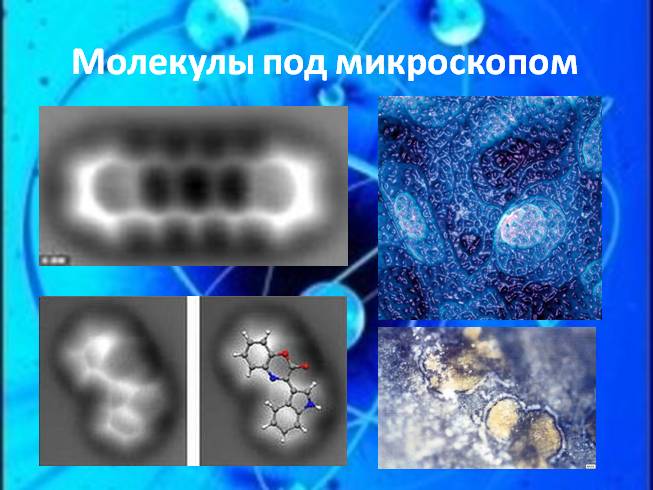
Молекулы под микроскопом

Самые крупные молекулыМожно увидеть невооружённым глазом – это одна волосинка синтетической ваты.

lusana.ru
Описание презентации по отдельным слайдам:
1 слайд Описание слайда: 2 слайд
Описание слайда: 2 слайд  Описание слайда:
Описание слайда: Какие из перечисленных явлений относятся к физическим 1. Закипела вода в чайнике. 2. Прокисло молоко. 3. Горят дрова в печи. 4. Распустился подснежник. 5. Звенит звонок с урока.
3 слайд Описание слайда:
Описание слайда: Выберите из перечисленного вещества. 1. Вода в стакане. 2. Снежный ком. 3. Железнодорожный рельс 4. Стекло. 5. Лист клёна.
4 слайд Описание слайда:
Описание слайда: Что здесь лишнее 1. Термометр. 2. Весы. 3. Насос. 4. Линейка. 5. Мензурка.
5 слайд Описание слайда:
Описание слайда: Если капнуть каплю краски в стакан с водой, то… Если открыть флакон с духами, то… Если нагреть лёд, то… Если сжать два кусочка пластилина, то… Если с силой ударить по стеклу, то… Если опустить термометр в горячую воду, то…
6 слайд Описание слайда: 7 слайд
Описание слайда: 7 слайд 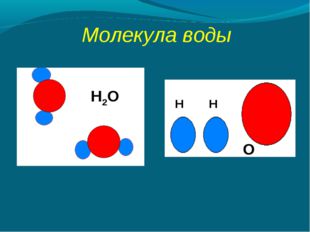 Описание слайда:
Описание слайда: Молекула воды Н2О Н Н О
8 слайд Описание слайда: 9 слайд
Описание слайда: 9 слайд 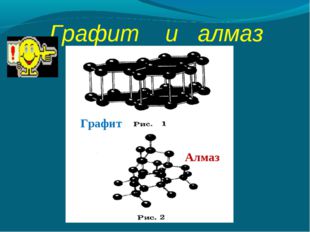 Описание слайда:
Описание слайда: Графит и алмаз Графит Алмаз
10 слайд Описание слайда: 11 слайд
Описание слайда: 11 слайд  Описание слайда: 12 слайд
Описание слайда: 12 слайд  Описание слайда:
Описание слайда: Решать загадки можно вечно. Вселенная ведь бесконечна. Спасибо всем нам за урок, А главное, чтоб был он впрок!
Найдите материал к любому уроку,указав свой предмет (категорию), класс, учебник и тему:
Выберите категорию: Все категорииАлгебраАнглийский языкАстрономияБиологияВсемирная историяВсеобщая историяГеографияГеометрияДиректору, завучуДоп. образованиеДошкольное образованиеДругоеДругойЕстествознаниеИЗО, МХКИзобразительное искусствоИностранные языкиИнформатикаИскусствоИспанский языкИсторияИстория РоссииИстория Средних вековИтальянский языкКлассному руководителюКультурологияЛитератураЛитературное чтениеЛогопедияМатематикаМировая художественная культураМузыкаМХКНачальные классыНемецкий языкОБЖОбществознаниеОкружающий мирОсновы безопасности жизнедеятельностиПриродоведениеРелигиоведениеРисованиеРусский языкСоциальному педагогуТехнологияУкраинский языкФизикаФизическая культураФилософияФинский языкФранцузский языкХимияЧерчениеЧтениеШкольному психологуЭкология
Выберите класс: Все классыДошкольники1 класс2 класс3 класс4 класс5 класс6 класс7 класс8 класс9 класс10 класс11 класс
Выберите учебник: Все учебники
Выберите тему: Все темы
также Вы можете выбрать тип материала:

Общая информация
Номер материала: ДВ-055827
Похожие материалы
Оставьте свой комментарийinfourok.ru
Урок 3. Вещества. Атомы и химические элементы. Молекулы. Простые и сложные вещества
Цель: формировать представление о составе и строении веществ, понятие «вещество», «молекула», «атом», властивости веществ; умение различать простые и сложные вещества; развивать абстрактное мышление, воспитывать коммуникативные способности.
Оборудование: пластилин, Периодическая таблица химических элементов Д. и. Менделеева, кусок мела, микроскоп.
Тип урока: формирование новых знаний.
Ход урока
I. Врганізаційний момент
II. Актуализация опорных знаний
♦ Что называют телами?
♦ Назвать характеристики тел.
♦ Какими пособиями можно измерять характеристики тел.
♦ Назовите примеры форм тел.
♦ Какие единицы измерения вы знаете?
III. Изучение нового материала
1. Вещества и их свойства
Вещество — это то, из чего состоит физическое тело. Из одного вещества можно изготовить различные тела. Какие тела можно изготовить из дерева; из пластмассы? Назовите похожие тела, состоящие из разных веществ. Вещества могут быть природными и искусственными, то есть синтезированными человеком.
2. Атомы, молекулы. Химические элементы
Для того чтобы выяснить, что представляет собой вещество, возьмем небольшой кусок мела и попробуем его измельчить на маленькие неделимые частицы. (Растереть мел до состояния порошка и показать под микроскопом, что камни остаются.)
Еще до нашей эры ученый Аристотель предложил называть эти частицы атомами. Атом — мельчайшая, химически неделимая частица вещества. Совокупность одинаковых атомов, имеющих одинаковое строение, называют химическим элементом.
Человеку известно более 100 элементов. Например, эта проволока алюминиевая, потому что состоит из атомов химического элемента Алюминия. Это кольцо из золота, потому что состоит из атомов химического элемента Ауруму. Кислород, которым мы дышим, состоит из атомов Кислорода (запись на доске).
Кислород — название вещества, Кислород — это название элемента. То есть не всегда название вещества совпадает с названием химического элемента.
Вещество | Химический элемент |
Золото | Аурум |
Серебро | Аргентум |
Железо | Ферум |
Водород | Водород |
Учитель предлагает практическую работу в игровой форме.
Передо мной шарики (из пластилина). Представьте, что белые — это атомы Кислорода, черные — атомы Водорода, желтые — атомы Карбона. Атомы имеют свойство сочетаться между собой. (Учитель демонстрирует соединение пластилиновых шариков на примере молекул кислорода, водорода, воды.)
Попробуйте самостоятельно получить молекулы углекислого газа, если он состоит из двух атомов Кислорода и одного атома Углерода.
В результате сочетания атомов образуются частицы, которые называются молекулами. Например, из атомов Натрия и Хлора образуется молекула каменной соли (демонстрация вещества) или, скажем, молекула всем известной ржавчины состоит из атомов Железа (железа) и атома Кислорода.
3. Простые и сложные вещества
Работа в парах. Посмотрите на собранные нами молекулы веществ. Попробуйте разделить их на две группы. (Обсудить, по каким признакам и почему.)
IV. Закрепление новых знаний
1. Беседа
♦ Что называют веществом?
♦ Какие свойства имеет вещество?
♦ Из каких частиц состоят молекулы?
♦ Что называют атомами?
♦ Что называют простым веществом? сложной?
♦ Приведите примеры простых и сложных веществ.
2. Распределите предложенные термины на две группы — вещества и молекулы. Заполните таблицу.
Кислород, графит, Водород, Карбон, вода, железо, Ферум, Аурум, серебро.
Вещество | Химический элемент |
|
|
3. Докажите, что минеральная вода является сложным веществом.
V. Итог урока
VИ. Домашнее задание
♦ Проработать текст учебника.
♦ Индивидуальное задание. Разработать кроссворд (5-6 понятий) с использованием понятий и терминов данной темы.
schooled.ru