Многие люди не раз слышали словосочетание «природный газ» и даже пользовались им, но до конца не понимают, что это такое. Прежде всего стоит разобраться, природный газ это смесь или чистое вещество. Исходя из того, что в различных местах зарождения имеются различные сочетания данного вещества, то это смесь нескольких газов. Они обрезаются в недрах планеты во время анаэробного разложения органических веществ, которые находятся под ее поверхностью. Это натуральное природное ископаемое, которое добывается в том же виде, в котором и используется. В пластовых условиях вещество находится в газообразном состоянии. Также встречаются газовые шапки в месте рождения нефти. В растворенном состоянии вещество может находиться в воде или нефти.
Преимущественно в таких газах содержится метан. Его соотношения в различных случаях может достигать, примерно, 82-98%. Практически всегда в таких газах есть примесь в виде азота, углекислого газа и водяных паров. Водорода в примесях встречается очень редко. Это минимизирует количество сжимающихся составляющих в смеси.

Данное вещество применяется в сварочной сфере достаточно активно. Его можно встретить при поверхностной кислородной и разделительной резке. Также им производится непосредственное сваривание стальных деталей. С учетом того, что природный газ не обеспечивает столь высокую температуру, как остальные защитные газы, его можно применять для заготовок, толщина которых не превышает 5 мм. Больше всего он востребован при сварке легкоплавких сплавов и металлов. Помимо этого, его применяют в пайке. Практически все процессы газопламенной обработки, где используется данное вещество, не имеют потребности в высокой температуре пламени. Здесь же могут использоваться смеси природного газа с генераторным или коксовым. Свойства смеси, предназначенной для использования в сварке, регламентируется ГОСТ 5542-87.
Благодаря своей относительно невысокой стоимости, для самых простых процедур, чтобы понизить себестоимость шва, специалисты стараются использовать именно этот расходный материал. Он хранится в баллонах при меньшем давлении чем другие защитные газы, поэтому, если использование является более безопасным.

Природный газ — это смесь из нескольких газов. Естественною, что при наличии такого термина многие люди могут подумать, что это отдельное образование, которое имеет свою формулу и так далее. Но на самом деле это несколько газов, зародившихся в одном месте при весьма схожих условиях. Даже с учетом того, что в некоторых случаях состав может отличаться более чем на 10%, основные свойства газа остаются почти одинаковыми, за некоторыми исключениями. Для промышленности подобные отклонения не имеют большого значения, так как во время ответственных работ такое вещество не применяется.
Определением того, что именно из себя представляет природный газ, задались еще в позапрошлом веке. В 1813 году Гемфри Деви определил, что газ с рудников и с болот имеет очень схожий состав и является смесью нескольких газов. Так было открыто понятие природного газа и создана отдельная его классификация.

Физические характеристики во многом определяются составом, но в среднем параметры выглядят следующим образом:

Основную часть вещества составляет метан, содержание которого колеблется от 70 до 98%. Вместе с ним в составе содержатся тяжелые углероды, такие как:
Помимо этого, в составе встречаются те вещества, которые не относятся к углеводородам. Среди них:

Состав природного газа
В техническом газе порой встречаются еще одоранты, вещества, которые придают запах. Это обусловлено тем, что в природном состоянии природный газ не имеет запаха и цвета.

Использование природного газа в сварке встречается довольно часто. Принципиальных отличий в использовании его от других защитных газов в сварке не наблюдается. Он применяется для самых простых работ, но здесь также нужно применять правила безопасности. Когда проведены все подготовительные операции, следует включить горелку и продуть ее при помощи этого вещества. Когда будет слышен запах с горелки, то можно поджигать и подавать кислород.
«Важно!
Баллон от источника тепла должен находиться на расстоянии от 5 метров и дальше.»
Для каждого типа сварки нужно применять свои режимы. Они выставляются заранее, согласно требуемой технологии и только после этого начинается непосредственное сваривание. В некоторых случаях, когда нужно подогревать металл до и после создания шва, горелка ставится на режим с более низкой температурой

По аналогии с природным, некоторые люди задаются вопросом, углекислый газ чистое вещество или смесь. Здесь ответ будет более простым, так как для обозначения данного расходного материала имеется формула СО2. Это показывает, что углекислота является отдельным веществом с постоянной формулой. Природный газ не имеет постоянной формулы, что характеризует его как смесь.
Природный газ знаком практически всем, а не только сварщикам, так как сфера его применения очень широка. Он встречается не только в области сварки, но и в отоплении, приготовлении пищи и так далее. Для сваривания металлов требуется качественная смесь с определенным соотношением, благодаря чему и существуют различные государственные стандарты по применению.
svarkaipayka.ru
Вся наша жизнь в буквальном смысле построена на работе различных химических веществ. Мы дышим воздухом, который содержит в себе множество различных газов. На выходе получается углекислый газ, который затем перерабатывается растениями. Мы пьем воду или молоко, которое представляет собой смесь воды с другими компонентами (жиром, минеральными солями, белком и так далее).
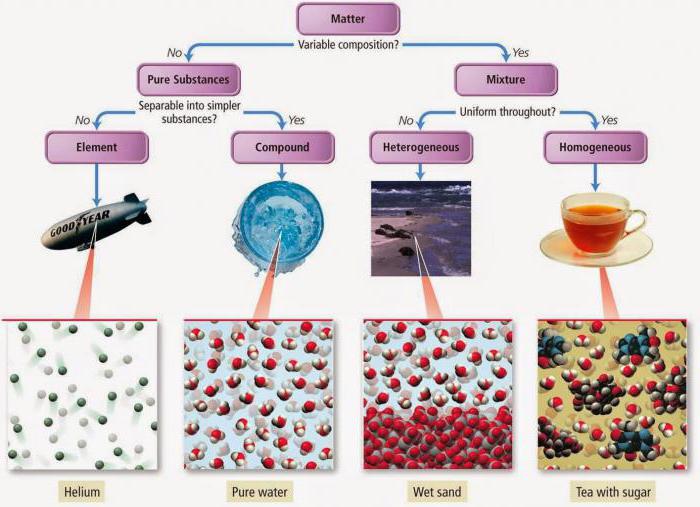
Банальное яблоко – это целый комплекс сложных химических веществ, которые взаимодействуют друг с другом и нашим организмом. Как только что-то попадает в наш желудок, вещества, входящие в продукт, поглощенный нами, начинают взаимодействие с желудочным соком. Абсолютно каждый объект: человек, овощ, животное – это набор частиц и веществ. Последние делятся на два разных типа: чистые вещества и смеси. В данном материале разберемся, какие вещества чистые, а какие из них относятся к категории смесей. Рассмотрим способы разделения смесей. А также взглянем на типичные примеры чистых веществ.

Итак, в химии чистые вещества – это те вещества, что всегда состоят только из одного-единственного вида частиц. И это первое важное свойство. Чистым веществом является вода, например, которая состоит исключительно из молекул воды (то есть своих собственных). Также чистое вещество всегда имеет постоянный состав. Таким образом, каждая молекула воды состоит из двух атомов водорода и из одного атома кислорода.
Свойства чистых веществ, в отличие от смесей имеют постоянный характер и изменяются при появлении примесей. Только дистиллированная вода имеет температуру кипения, а морская кипит при более высокой температуре. При этом стоит учитывать, что любое чистое вещество не является абсолютно чистым, так как даже чистый алюминий имеет примесь в составе, хоть она и имеет долю в 0.001 %. Возникает вопрос, как выяснить массу чистого вещества? Формула для вычисления выглядит следующим образом – m (масса) чистого вещества = W (концентрация) чистого вещества * смесь / 100 %.
Также существует такой тип чистых веществ, как особо чистые вещества (ультрачистые, высокочистые). Такие вещества используются в производстве полупроводников в различных измерительных и вычислительных устройствах, атомной энергетике и во многих других профессиональных областях.

Мы уже выяснили, что чистым веществом является то, что содержит в себе элементы одного вида. Хорошим примером чистого вещества может послужить снег. По сути это та же вода, но в отличие от той воды, с которой мы сталкиваемся ежедневно, эта вода гораздо чище и не содержит примесей. Алмаз тоже является чистым веществом, поскольку он содержит в себе только углерод без примесей. Это же относится и к горному хрусталю. На ежедневной основе мы сталкиваемся с еще одним примером чистого вещества – рафинированным сахаром, который содержит в себе одну лишь сахарозу.
Мы уже рассмотрели чистые вещества и примеры чистых веществ, теперь перейдем к другой категории веществ – смесям. Смесь – это когда несколько веществ смешиваются друг с другом. Мы сталкиваемся со смесями на постоянной основе даже в быту. Тот же чай или мыльный раствор представляют собой смеси, которые мы применяем ежедневно. Смеси могут быть созданы человеком, а могут быть природными. Они находятся в твердом, жидком и газообразном состоянии. Как уже было сказано выше, тот же чай является смесью воды, сахара и чая. Это пример смеси, созданной человеком. Молоко является природной смесью, так как оно появляется без участия человека в процессе выработки и содержит в себе множество разных компонентов.

Смеси созданные человеком почти всегда долговечны, а природные под воздействием тепла начинают распадаться на отдельные частицы (молоко, к примеру, прокисает через несколько дней). Смеси также делятся на гетерогенные и гомогенные. Гетерогенные смеси являются неоднородными, а их компоненты видны невооруженным взглядом и под микроскопом. Такие смеси именуют взвесями, которые в свою очередь делят на суспензии (вещество в твердом состоянии и вещество в жидком состоянии) и эмульсии (два вещества в жидком состоянии). Гомогенные смеси однородные, а их отдельные компоненты невозможно рассмотреть. Их также именуют растворами (могут быть веществами в газообразном, жидком или твердом состоянии).
Для удобства восприятия информация представлена в виде таблицы.
Сравнительный признак | Чистые вещества | Смеси |
Состав веществ | Сохраняют постоянный состав | Имеют непостоянный состав |
Виды веществ | Содержат одно вещество | Включают в себя различные вещества |
Физические свойства | Сохраняют постоянные физические свойства | Имеют непостоянные физические свойства |
Изменение энергии вещества | Изменяется при образовании энергии | Не изменяется |

В природе многие вещества существуют в виде смесей. Они применяются в фармакологии, промышленном производстве.
Для получения чистых веществ применяются различные методы разделения. Гетерогенные смеси делят с помощью отстаивания и фильтрования. Гомогенные смеси делят с помощью выпаривания и дистилляции. Рассмотрим каждый способ отдельно.
Этот метод используется для разделения суспензий, таких как смесь речного песка с водой. Главным принципом, на котором основывается процесс отстаивания, является разница в плотностях тех веществ, которые будут разделены. Например, одно тяжелое вещество и вода. Какие чистые вещества тяжелее воды? Это песок, например, который в силу своей массы начнет оседать на дно. Таким же образом разделяют различные эмульсии. Например, от воды можно отделить растительное масло или нефть. Эти вещества в процессе разделения образуют небольшую пленку на поверхности воды. В лабораторных условиях этот же процесс проводят с использованием делительной воронки. Этот способ разделения смесей работает и в природе (без участия человека). Например, осаждение сажи из дыма и отстаивание сливок в молоке.
Этот метод подходит для получения чистых веществ из гетерогенных смесей, например, из смеси воды с поваренной солью. Итак, каким образом работает фильтрация в процессе разделения частиц смеси? Суть заключается в том, что у веществ различные уровни растворимости и размеры частиц.
Фильтр конструируется таким образом, чтобы через него могли пройти только частицы с той же растворимостью или тем же размером, что он может пропустить. Более крупные и другие неподходящие частицы не смогут пройти через фильтр и будут отсеяны. Роль фильтров могут играть не только специализированные устройства и растворы в пределах лаборатории, но и знакомые всем вещи, такие как вата, уголь, обожженная глина, спрессованное стекло и другие пористые объекты. Фильтры используются в реальной жизни гораздо чаще, чем может показаться.
По такому принципу работает всем нам знакомый пылесос, который отделяет крупные частицы мусора и ловко всасывает мелкие, неспособные повредить механизм. Когда вы болеете, то надеваете марлевую повязку, которая может отсеять бактерии. Рабочие, чья профессия связана с распространением опасных газов и пыли, носят респираторные маски, защищающие их от отравления.
Таким способом можно разделить смесь порошка железа и серы. Принцип разделения основан на воздействии магнита на железо. Частицы железа притягиваются к магниту, в то время как сера останется на месте. Этот же метод можно использовать для отделения других металлических деталей из общей массы разных материалов.
Если порошок серы, смешанный с порошком железа высыпать в воду, то несмачиваемые частицы серы всплывут на поверхность воды, в то время как тяжелое железо сразу же ляжет на дно.
Этот способ работает с гомогенными смесями, такими как раствор соли в воде. Это работает в естественных природных процессах и лабораторных условиях. Например, некоторые озера при нагревание испаряют воду, а на ее месте остается поваренная соль. С точки зрения химии, этот процесс основывается на том, что разница между температурой кипения двух веществ, не позволяет им испариться единовременно. Уничтоженная вода обратится в пар, а оставшаяся соль останется в своем обычном состоянии.
Если вещество, которое нужно извлечь (сахар, например) плавится при нагревании, то воду не испаряют полностью. Смесь сначала прогревают, а затем получившуюся модифицированную смесь настаивают, чтобы частицы сахара осели на дне. Иногда стоит более сложная задача - отделение вещества с более высокой температурой кипения. Например, отделение воды от соли. В таком случае, испаренное вещество необходимо собрать, охладить и сконденсировать. Этот метод разделения гомогенных смесей называют дистилляцией (или просто перегонкой). Существуют специальные устройства, которые дистиллируют воду. Такая вода (дистиллированная) активно используется в фармакологии или в автомобильных системах охлаждения. Естественно, этим же методом люди перегоняют спирт.

Последний метод отделения – хроматография. Он основан на том, что некоторые вещества имеют свойство поглощать другие компоненты веществ. Это работает следующим образом. Если вы возьмете кусочек бумаги или ткани, на которой что-то написано чернилами и погрузите ее часть в воду, то заметите следующее: вода начнет впитываться бумагой или тканью и будет ползти вверх, а вот красящее вещество будет немного отставать. Используя данную методику ученый М. С. Цвет смог отделить хлорофилл (вещество, дающее зеленый окрас растениям) от зеленых частей растения.
fb.ru
Зажигая горелку на кухне, мало кто из хозяек задумывается, как давно люди стали использовать природный газ в качестве топлива. Эта история насчитывает не века, а тысячелетия: в IV веке до н. э. китайцы обогревались и освещали жилища при помощи бездымного голубоватого огня.
В России промышленная разработка месторождений природного газа началась в прошлом веке, а до этого его находили только при добыче нефти или бурении скважин для воды.
Русская смекалка всегда помогала людям с пользой применять все, что встречается на пути. Когда в Саратовской губернии один купец начал бурить артезианскую скважину и обнаружил не воду, а огонь, он с выгодой воспользовался ситуацией и организовал там стекольное и кирпичное производство.
Другие промышленники переняли его опыт, и бесполезный подземный газ стал постепенно превращаться в ценное топливо.
Без специальных приборов невозможно определить, что в воздухе присутсвует огнеопасный компонент, который может оказаться причиной пожара.
С точки зрения экологии газ – самое чистое природное топливо, ведь при горении он выделяет намного меньше вредных соединений, чем дрова, уголь или нефть. Это качество делает его востребованным во всех странах мира. Государства, имеющие на своей территории крупные месторождения, используют его и для своих нужд, и для продажи другим народам. Природа подарила России богатейший Уренгой, Казахстану – Карачаганакское месторождение, не обделила она и страны Персидского залива, США, Канаду.Недра земли создали не только огромные подземные резервуары природного газа – его запасы хранятся и в более компактном виде. В холодных регионах и под дном океана, где гидростатическое давление доходит до 250 атмосфер, происходит соединение газа с пластовой водой и образуется твердое вещество – газогидрат. В небольших объемах находится огромное количество природного топлива, в связанном виде газ уменьшается до 220 раз.
Сотни миллионов лет назад на месте сегодняшних материков плескался океан. Погибшие обитатели водной стихии падали на дно и превращались в ил. Они не могли разлагаться, поскольку там не было ни воздуха для окисления, ни бактерий, вызывающих гниение. Движение земной коры способствовало погружению этих масс все дальше вглубь. Высокое давление и температура вызывали химические реакции, при которых углерод органических остатков соединялся с водородом, и образовывались новые вещества – углеводороды.
 Если давление и температура были не очень высокими, получались высокомолекулярные жидкости, которые со временем превратились в нефть. Когда эти параметры достигали больших величин, образовывались низкомолекулярные газы.
Если давление и температура были не очень высокими, получались высокомолекулярные жидкости, которые со временем превратились в нефть. Когда эти параметры достигали больших величин, образовывались низкомолекулярные газы.
Соединения покрывались осадочными породами и оказались глубоко под поверхностью земли. Геологи находят эти полезные ископаемые на глубине от одного до шести километров.
Существует и другая теория образования природных газов. Некоторые ученые считают, что углеводороды в результате тектонических движений постепенно поднимаются наверх, где давление не так велико, и образуют большие скопления нефти и газа.
Земные породы не монолитны – в них есть мелкие трещины и поры. Газообразные вещества заполняют эти пустоты, поэтому природный газ есть не только в крупных месторождениях, но и в камнях, находящихся на большой глубине.
Природный газ не обособленное вещество – это смесь разных компонентов, основной из которых – метан.
 Невозможно найти два абсолютно идентичных образца из разных месторождений: в каждом из них состав индивидуален.
Невозможно найти два абсолютно идентичных образца из разных месторождений: в каждом из них состав индивидуален.
Для его образования были использованы разные органические остатки, условия протекания химических реакций тоже не были одинаковыми.
Ни один ученый не сможет дать вам химическую формулу природного газа – он может только сообщить процентный состав входящих в него веществ. Дополнительными составляющими кроме метана являются углеводороды:
Из химического состава вытекают и физические свойства природного топлива. Точных параметров тоже нет, ведь они зависят от процентного соотношения компонентов:
Поскольку природный газ почти в два раза легче воздуха, он поднимается вверх. Человек не может задохнуться, оказавшись на дне низины. Но есть другая опасность: если в воздухе присутствует от 5 до 15 % объема природного газа, смесь становится взрывоопасной.
На его основе разработана газотопливная система, применяемая в автомобилях. Октановое число природного газа, используемого в двигателях, – от 120 до 130.
Горение природного газа процесс достаточно сложный, при котором химическая энергия преобразуется в тепло. Горение бывает полным и неполным.
На первый взгляд, в использовании газа нет ничего сложного. Проложить трубы, пробурить скважину – и голубое топливо, находящееся в недрах под большим давлением, само потечет к котлам и плитам. Но не все так просто – природный газ содержит примеси, которые могут причинить вред трубопроводам, приборам или здоровью людей.
В глубине земли много влаги, которая может вступать в химические реакции или создавать конденсат, а большое количество его мешает проходу газа. Сероводород вызывает ржавление металла, и оборудование быстро приходит в негодность. Чтобы удалить из сырья вредные компоненты, на месторождениях устанавливают специальные станции очистки.
 Газопроводы имеют протяженность много тысяч километров, начальной энергии потока не хватит, чтобы преодолеть такие расстояния.
Газопроводы имеют протяженность много тысяч километров, начальной энергии потока не хватит, чтобы преодолеть такие расстояния.
Какими бы гладкими ни были внутренние поверхности, все равно возникает сила трения, газ теряет скорость и нагревается.
Чтобы отправить его дальше, строятся компрессорные станции, где голубое топливо охлаждают и придают ему дополнительное давление.
Существуют и другие способы транспортировки газа, но пока трубопроводы являются самыми экономичными.
Природный газ не имеет запаха, так почему же жильцы квартир сразу чувствуют, если где-то происходит утечка? Для нашей безопасности в голубое топливо добавляют специальные одоранты, малейшее присутствие которых чувствительно для обоняния человека. Обычно в этой роли выступают меркаптаны, имеющие настолько неприятный запах, что не заметить его невозможно.
 На всем протяжении своей истории человечество обогревалось, сжигая различные виды топлива.
На всем протяжении своей истории человечество обогревалось, сжигая различные виды топлива.
Сейчас самым экономичным и безопасным признан природный газ, но у него есть недостаток, характерный для любого горючего сырья: при сжигании в атмосферу выбрасывается углекислый газ, создающий парниковый эффект.
Ученые всего мира заняты поисками альтернативных источников тепловой энергии, но пока они их ищут, голубое топливо будет востребовано во всех уголках земного шара.
greenologia.ru
Окружающий мир (3-й класс)
Тема: Путешествие в мир веществ
Из чего состоит вещество
Цели:
Ознакомиться с составом веществ (состоят из частиц) ; формировать умение классифицировать предметы по существенным признакам;
Развивать воображение, логическое мышление фантазию и познавательный интерес к тайнам природы;
Воспитывать интерес к опытно – экспериментальной исследовательской деятельности.
Оборудование: химические стаканы, колба с водой, соль, сахар, чернила, спиртовка, штатив, чашка (стекло) для выпаривания, кусочки льда, мокрая ткань; плакат «Из чего состоит вещество» из комплекта «Наглядные материалы по окружающему миру для 3-го класса».
Этапы урока
Ход урока
Формирование УУД
и технология оценивания учебных успехов
Ι. Актуализация знаний и постановка учебной проблемы.
Учитель: - С добрым утром!
Начат день.
Первым делом гоним лень.
На уроке не скучать,
А работать и читать!
Настроение бодрое, весёлое у всех? Тогда вперёд!
– Ребята, мы сегодня выступим на уроке в роли экспериментаторов, побываем в небольшой химической лаборатории и проведём несколько опытов. Ваша задача – внимательно наблюдать, всё запоминать и пытаться объяснять увиденное. Готовы? Тогда начнём. Я в стакан наливаю чистой воды и добавляю обычный сахар (можно соль), размешиваю.
– Что интересного заметили? Какие вы видите факты? Какой возникает вопрос? (Мы взяли два вещества, смешали. Одно вещество исчезло, стало невидимым.)
– Куда исчез сахар?
– Какие есть гипотезы?
– Для опровержения гипотезы, что сахар исчез, можно провести опыт по выпариванию полученного раствора сахара, можно попробовать на вкус.
– Сахар – это тело или вещество?
– Каким надо быть, чтобы тебя не видели?
– Попробуйте сформулировать проблему сегодняшнего урока: чем мы будем заниматься? Принимаем все возможные версии, корректируем их и приходим к итоговой: из чего состоит вещество? (Записать на доске.)
– Какова будет тема урока?
План (примерный) 3
1.
 – Что мы сейчас с вами делали? (Планировали нашу деятельность.)
– Что мы сейчас с вами делали? (Планировали нашу деятельность.)
– Какое умение формировали?
– Ребята, а что мы знаем для того, чтобы ответить на вопрос урока?
– Что общего у снега, льда и воды?
– Куда исчезает вода из сохнущего мокрого белья?
– Чувствуете ли вы запах духов на столе?
– Обобщите все ответы: что можете сказать о «веществе»? (Вещество может выглядеть по-разному.)
Познавательные УУД
1. Развиваем умения извлекать информацию из схем, иллюстраций, текстов.
2. Представлять информацию в виде схемы.
3. Выявлять сущность, особенности объектов.
4. На основе анализа объектов делать выводы.
5. Обобщать и классифицировать по признакам.
6. Ориентироваться на развороте учебника.
7. Находить ответы на вопросы в иллюстрации.
Коммуникативные УУД
1. Развиваем умение слушать и понимать других.
2. Строить речевое высказывание в соответствии с поставленными задачами.
3. Оформлять свои мысли в устной форме.
4. Умение работать в паре и в группах.
ΙΙ. Совместное открытие знаний.
1 4 3 4 3
1. Работа в учебнике.
– Выполните задание на с. 10.
– Чем различаются тела, приведённые вами?
– Чем различаются вещества?
– Хотите узнать? Прочитайте первый абзац на с. 11 и выделите ключевые слова.
– Как вы ответите на вопрос, используя ключевые слова?
– Итак, все вещества состоят из молекул. А вот эти молекулы в разных веществах одинаковы?
2. Практическая работа.
– Для проверки наших версий проведём эксперимент. Вот у меня, например, всем знакомое вещество соль, давайте проведём аналогичный опыт, как и с сахаром. Итак, соль растворилась, мы видим молекулы соли? Давайте выпарим и посмотрим, есть ли соль в полученном нами растворе? Значит, молекулы сахара и соли одинаковы? А почему вы так считаете?
– Давайте проведём ещё один опыт, и его результаты сравним с предыдущими. У меня в стакане чистая вода, в другом стакане чернила. В третьем стакане смешаем воду и чернила. Что наблюдаете?
– В каком стакане заметно, что частицы разных сортов? Можем ли мы сказать, что в этом стакане чистые чернила или чистая вода?
– Давайте посмотрим, как учёные называют такие вещества. Найдите это название в тексте на с. 11.
– Ребята, а как вы думаете, дома из водопроводного крана у нас течёт чистая вода или …? Почему вы так считаете?
3. Работа в учебнике.
– Выполните задание к рисунку на с. 11.
– Как вы считаете воздух – это вещество или смесь веществ? Докажите. (Воздух – смесь веществ, в нём есть кислород, которым мы дышим, и углекислый газ, который выдыхаем.)
– Ребята, давайте посмотрим… ой! В начале урока был кусочек льда, и салфетка была мокрая, а сейчас посмотрите, что с ними произошло… В чём же дело? (Лёд растаял, и образовалась небольшая лужица, а салфетка высохла.)
– Лёд, жидкая вода, пар – это вещество одно и то же? А что разное?
– Почему же они так непохожи? Может, у них разные молекулы, но вещество-то одно? Давайте вспомним свойства веществ в разных состояниях. Рассмотрите таблицу и рисунки на с. 11
– Почему свойства вещества в разных состояниях разные? Давайте проверим наше предположение по учебнику, текст на с. 12 после таблички.
– Задание на с. 13.
– Давайте немного поиграем. Для этого прочитайте текст после рисунка со схемами, и каждая группа, выбрав нужную информацию, изобразит поведение молекул. При этом нельзя ничего говорить, а можно показывать только мимикой, жестами или действиями. 1-й ряд отвечает за вещество в жидком состоянии; 2-й ряд – за вещество в твёрдом состоянии; 3-й ряд – за вещество в газообразном состоянии.
– Какой проблемный вопрос мы сегодня решали? Мы справились с этой проблемой? Как? Сделайте вывод.
 – Что мы сейчас делали?
– Что мы сейчас делали?
 – Какие умения формировали?
– Какие умения формировали?
Личностные результаты
1. Развиваем умения выказывать своё отношение к героям,
выражать свои эмоции.
2. Оценивать поступки в соответствии с определённой ситуацией.
3. Формируем мотивацию к обучению и целенаправленной познавательной деятельности.
ΙΙΙ. Самостоятельное применение знаний.
2 1
1. Работа в учебнике.
– Вопросы на с. 13.
– Выполните задания из рабочей тетради на выбор.
Вопросы к ученику, выполнявшему работу (начало формирования алгоритма самооценки):
– Что тебе нужно было сделать?
– Удалось тебе выполнить задание?
– Ты сделал всё правильно или были недочёты?
– Ты составил всё сам или с чьей-то помощью?
– Какой был уровень задания?
– Какие умения формировались при выполнении этого задания?
– Сейчас мы вместе с … (имя ученика) учились оценивать свою работу.
2. Работа в группах
Возможные ответы на задания проверочной работы № 1.
Вариант 1. 1) Повышенный уровень. Тела – все предметы, которые нас окружают. Чистые вещества – вещества, состоящие из одинаковых молекул. Смеси – вещества, состоящие из различных молекул. Вещество – то, из чего состоят тела. 2) Необходимый уровень. Твёрдые тела – металл, чугун, мел, уголь. Повышенный уровень. Жидкости – бензин, молоко, вода; газы – природный газ, кислород, углекислый газ. 3) Повышенный уровень. Молоко – это смесь. Из молока, оставленного в тёплом помещении, образуются сметана, простокваша и сыворотка.
Вариант 2. 1) Повышенный уровень. Тела – все предметы, которые нас окружают. Чистые вещества – вещества, состоящие из одинаковых молекул. Смеси – вещества, состоящие из различных молекул. Вещество – то, из чего состоят предметы. 2) Необходимый уровень. Твёрдые тела – металл, сахар, вода (–10 0С), древесина, мороженое (из холодильника), пластмасса. Повышенный уровень. Жидкости – кофе, молоко, бульон, мороженое (стояло 1 час в тепле). Газообразные вещества – пар, вода (100 0С), воздух, кислород, природный газ, углекислый газ. 3) Необходимый уровень. Смеси: молоко, кофе, чернила, природный газ (такой ответ можно признать верным, так как природный газ встречается с примесями в природе), бульон, почва.
Регулятивные УУД
1. Развиваем умение высказывать своё предположение на основе работы с материалом учебника.
2. Оценивать учебные действия в соответствии с поставленной задачей.
3. Прогнозировать
предстоящую работу (составлять план).
4. Осуществлять познавательную и личностную рефлексию.
ТОУУ
ΙV. Домашнее задание.
Чтение текста темы 2 на с. 10–13, обратить внимание, что текст на с. 14–15 для любознательных, читать только по желанию.
V. Итог урока.
– Какую работу мы сейчас выполняли?
– Чему научились?
– Кто с ней справлялся легко?
– Кому пока было трудновато?
– Кто или что вам помогло справиться?
– Кто доволен сегодня своей работой?
– Кто хотел бы что исправить? Что? Что для этого нужно сделать?
– Какую бы отметку вы себе поставили?
– Что нового узнали?
– Где пригодятся знания?




infourok.ru
В 8-м классе школьники изучают в курсе химии чистые вещества и смеси. Наша статья поможет им разобраться в этой теме. Мы расскажем, какие вещества называют чистыми, а какие – смесями. А вы когда-нибудь задумывались над вопросом: «Существует ли абсолютно чистое вещество?» Возможно, ответ вас удивит.

Прежде чем рассматривать определение «чистого вещества», необходимо разобраться с вопросом: «С каким веществом мы на самом деле имеем дело – с чистым или смесью?»
Во все времена чистота вещества волновала не только научных сотрудников, ученых, но и простых людей. Что мы обычно вкладываем в это понятие? Каждый из нас хочет пить воду без примесей тяжелых металлов. Мы хотим дышать свежим воздухом, который не загрязнен выхлопными газами автомобилей. Но можно ли назвать незагрязненные воду и воздух чистыми веществами? С точки зрения науки – нет.
Итак, смесь – это вещество, которое содержит молекулы нескольких видов. Теперь подумайте о составе воды, кторая течет из крана – да-да, в ней много примесей. В свою очередь вещества, которые составляют смесь, называются компонентами. Рассмотрим пример. Воздух, которым мы дышим, – это смесь разных газов. Компоненты, входящие в его состав – кислород, азот, углекислый газ и так далее. В случае, если масса одного компонента в десятки раз меньше массы другого, то такое вещество называют примесью. Часто в природе встречается воздух, который загрязнен примесями сероводорода. Этот газ имеет запах тухлых яиц и является ядовитым для человека. Когда отдыхающие на берегу реки разводят костер, то он загрязняет воздух углекислым газом, который тоже опасен в большом количестве.
У особо догадливых ребят, возможно, уже возник вопрос: «Что чаще встречается – чистые вещества или смеси?» Отвечаем на ваш вопрос: «В основном все, что нас окружает – это смеси».
Таким удивительным образом устроена природа.

В начале статьи мы обещали рассказать о том, существуют ли вещества абсолютно без примесей. Как вы думаете, бывают ли такие? О водопроводной воде мы уже говорили. Номожет ли содержать в себе примеси родниковая вода? Ответ на этот вопрос прост: абсолютно чистые вещества в природе не встречаются. Однако в научных кругах принято говорить об относительной чистоте вещества. Звучит это так: «Вещество чистое, но с оговоркой». Так, например, оно может быть чистым технически. Чернила черные и фиолетовые содержат примеси. Если их нельзя обнаружить при помощи химической реакции, то такое вещество называют химически чистым. Такой бывает дистиллированная вода.
Итак, пришло время поговорить о чистом веществе. Это такое вещество, которое в своем составе имеет частицы только одного вида. Оказывается, оно имеет особенные свойства. У него есть еще одно название: индивидуальное вещество. Давайте попробуем охарактеризовать свойства чистой воды:

Этот вопрос тоже уместен. Очень часто в быту и на производстве (в большей мере) человек разделяет вещества. Так, например, в молоке образуются сливки, которые можно собрать с поверхности, если применить метод отстаивания. Во время переработки нефти человек производит бензин, ракетное топливо, керосин, машинное масло и так далее. На всех этапах переработки человек применяет самые разные способы разделения смесей, которые зависят от агрегатного состояния вещества. Рассмотрим каждый из них.
Данный метод применяют в том случае, когда есть жидкое вещество, в котором содержатся нерастворимые твердые частицы. Например, вода и речной песок. Такую смесь человек пропускает через фильтр. Таким образом, песок задерживается в фильтре, а чистая вода спокойно через него проходит. Мы редко придаем этому значение, но каждый день на кухне многие горожане пропускают воду из-под крана через очистительные фильтры. Так что в определенной степени вы можете считать себя учеными!

Об этом методе мы сказали несколько слов чуть выше. Однако рассмотрим его подробнее. К такому методу химики прибегают в случае, когда необходимо разделить суспензии или эмульсии. Например, если в чистую воду проникло растительное масло, то полученную смесь необходимо встряхнуть, затем дать ей настояться некоторое время. После этого человек будет наблюдать явление, когда масло в виде пленки покроет воду.
В лабораториях химики применяют еще один метод, который называется делительная воронка. При использовании этого способа очищения плотная жидкость проникает в емкость, а то, что легче – остается.
Метод отстаивания имеет серьезный недостаток – это низкая скорость протекания процесса. В этом случае необходимо длительное время для формирования осадка. На промышленных предприятиях такой способ все равно используют. Инженеры проектируют специальные конструкции, которые имеют название «отстойники».
Каждый из нас хотя бы раз в жизни играл с магнитом. Его удивительное свойство притягивать металлы казалось магическим. Находчивые люди догадались применить магнит для того, чтобы разделять смеси. Например, разделение деревянных и железных опилок возможно при помощи магнита. Но стоит учесть, что не все металлы он может притягивать, ему подвластны только те смеси, в которых содержатся ферромагнетики. К ним можно отнести никель, тербий, кобальт, эрбий и так далее.

Этот термин имеет латинские корни, в переводе означает «стекание каплями». Такой метод представляет собой разделение смесей, основанное на разницах температуры кипения веществ. Именно этот способ поможет разделить воду и спирт. Последнее вещество испаряется при +78°C. Когда его пары касаются холодных стенок и поверхностей, пары конденсируются, превращаясь в жидкое вещество.
В тяжелой промышленности данным методом добывают продукты нефти, чистые металлы, а также разнообразные душистые вещества.
Мы с вами говорили про чистые вещества и смеси в жидком и твердом состоянии. А как быть, если необходимо провести разделение газовых смесей? Светлые головы химической промышленности сегодня практикуют несколько физических способов разделения газообразных смесей:

Итак, в нашей статье мы с вами рассмотрели понятие чистых веществ и смесей. Мы выяснили, что чаще встречается в природе. Теперь вы знаете различные способы разделения смесей – и некоторые из них можете продемонсттрировать самостоятельно, например магнит. Надеемся, что наша статья была для вас полезной. Изучайте науку сегодня, чтобы завтра она помогла вам решить любую проблему – как у себя дома, так и на производстве!
fb.ru
В античные времена древнегреческими учёными было сформулировано предположение, которое позже полностью подтвердилось — о том, что вещества состоят из мельчайших невидимых глазу частиц.
Например, вода состоит из одинаковых частиц, называемых молекулами воды. Сахар состоит из одинаковых частиц, называемых молекулами сахара. Вода и сахар — это чистые вещества.
Чистыми веществами называются вещества, которые состоят из частиц одинакового вида.
Если же сахар смешать с водой, происходит диффузия — молекулы сахара проникают между молекулами воды. Образуется раствор, в состав которого входят как молекулы воды, так и молекулы сахара.Раствор — это смесь веществ.
Смесями называют вещества, в состав которых входят частицы разного вида.
Все вещества являются либо чистыми, либо смесями.

Чистые вещества состоят из частиц одного вида, а смеси — из частиц разного вида.
Кроме веществ, состоящих из молекул, существуют вещества, имеющие немолекулярное строение.
Например, металлы и инертные газы состоят не из молекул, а из более мелких частиц — атомов.
Таким образом, медь состоит только из атомов меди, а цинк состоит только из атомов цинка. Медь и цинк — чистые вещества. Если к меди добавить цинк и сильно нагреть, получится сплав, который называют латунью.
Латунь — это смесь, в состав которой входят как атомы меди, так и атомы цинка.
Существуют вещества немолекулярного строения, состоящие из частиц другого вида, называемых ионами. В состав ионных соединений входят не электрически нейтральные атомы или молекулы, а частицы, несущие на себе положительный или отрицательный заряд.
Примером таких веществ может служить хлорид натрия, то есть обычная поваренная соль, кристаллы которой состоят из положительно заряженных ионов натрия и отрицательно заряженных ионов хлора. Поваренная соль является чистым веществом. Если же её растворить в воде, образуется раствор, который является смесью двух веществ — воды и поваренной соли.
Сравнение чистых веществ и смесей
| Чистые вещества | |
| Состав | Чистое вещество состоит из частиц одного вида. Например, вода состоит только из молекул воды.
Чистое вещество имеет постоянный состав. Например, любая молекула воды состоит из двух атомов химического элемента водорода и одного атома химического элемента кислорода. | Смесь состоит из частиц разного вида. Например, раствор сахара в воде содержит как молекулы воды, так и молекулы сахара.
Смесь не имеет постоянного состава: содержание отдельных составных частей одной и той же смеси может быть разным. Условно говоря, в стакане воды можно растворить и одну чайную ложку сахара, и две. |
| Свойства | Чистое вещество имеет постоянные свойства. | В смеси каждое вещество в основном сохраняет свои свойства. Например, железо так же, как обычно, притягивается магнитом, поваренная соль остаётся солёной.
Физические свойства смеси отчасти меняются с изменением её количественного состава. |
Обрати внимание!
Следует иметь в виду, что идеально чистых веществ не существует, поскольку ни одно из веществ невозможно полностью очистить от содержащихся в нём примесей.
Какое же вещество в таком случае на практике считается чистым?Практически чистым (чистым) называют вещество, в котором содержание примесей столь ничтожно, что эти примеси существенным образом не влияют на его свойства.
Например, вода считается практически чистой, если образец жидкости не имеет цвета, вкуса и запаха, замерзает при температуре \(0\) °С, кипит при температуре \(+100\) °С, при температуре \(+4\) °С имеет плотность \(1000\) кг/м³ и практически не проводит электрический ток.
Чистые вещества: кислород, дистиллированная вода, рафинированный сахар
В некоторых отраслях науки и техники используют особо чистые вещества.


В банках золото хранится в слитках, массовая доля благородного металла в которых составляет \(99,9\) %; в технике для изготовления электронных приборов и микросхем используется кремний, чистота которого составляет \(99,999\) %.
В природе, в технике и в повседневной жизни большей частью приходится иметь дело со смесями. Так, смесью является воздух, природная вода, почва, биологические жидкости, пища и многое другое.
Смеси бывают двух видов: однородные (гомогенные) и неоднородные (гетерогенные).

www.yaklass.ru
В школе я обожала химию, но дальше школьного курса, к сожалению, не ушла. Учеба, работа - все не связано с химией. Но общие знания я вполне сохранила.
Формы веществ и их изменчивость - это вообще очень интересно.
Газы и жидкости, чистые вещества и смеси, растворы разнообразной концентрации... В каких только формах ни бывают химические вещества!
Идеально чистых веществ не существует, но если хотя 98% вещества имеет чистый состав, то такое вещество считается чистым.
Чистые вещества бывают простыми и сложными. Первые состоят из одного химического элемента, вторые - из нескольких.
Кислород (О) и водород (H) - простые вещества.
А вода (h3O) - сложное.
Смеси же состоят сразу из нескольких веществ.
Смеси бывают гомогенными и гетерогенными.
Гетерогенные - разнородные смеси, в которых выражены отдельные элементы.
Гомогенные смеси отличаются однородностью состава. Химические свойства во всех частях смеси одинаковы, смесь представляет собой одну химическую систему.
К гомогенным смесям относятся растворы, которые могут быть в трех формах:
Растворы - незаменимы в быту, промышленности, химических экспериментах.
Уксусная кислота в чистом виде опасна и вызывает серьезные химические ожоги. А вот в растворах разной концентрации известна, как уксусная эссенция и уксус.
Чистые вещества для природы нехарактерны. Большая часть существующих чистых веществ получена искусственно.
В природе все очень взаимосвязано и активно контактирует друг с другом, поэтому у вещества ну очень мало шансов остаться чистым.
Вода, казалось бы, чистое вещество, но природная вода содержит огромное количество примесей. Это относится как пресноводным водоемам, так и к солоноводным, где вода смешивается с солью (и не только).
Воздух - газообразная смесь разных веществ.
В самом человеке "намешано" много всего. Соляная кислота, которая в чистом виде вызывает химический ожог, в слабой концентрации содержится в желудочном соке.
Подведу итог. Смеси чаще встречаются в природе.
travelask.ru