В уроке 3 «Молекулы и простые вещества» из курса «Химия для чайников» рассмотрим, что такое молекулы, простые вещества, а также металлы и неметаллы. Напоминаю, что в прошлом уроке «Относительная атомная масса химических элементов» мы рассмотрели разные способы выражения массы химических элементов.

Атомы химических элементов существуют в природе как в свободном, так и в связанном состоянии. Например, благородные газы — гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe — находятся в воздухе в виде одиночных атомов. Атомы всех остальных элементов в природе не существуют изолированно друг от друга. Они всегда стремятся соединиться, связаться с другими атомами за счет особых сил. Почему? Так они достигают более устойчивого состояния. Это одна из иллюстраций всеобщего принципа природы — стремления к максимально устойчивому состоянию.
Из курса физики вы уже немного знаете о молекулах — частицах вещества, состоящих обычно из двух и более атомов. Что же такое молекула?
Молекула — наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
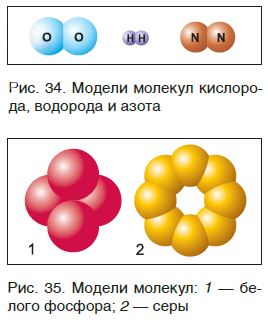
Молекулы благородных газов одноатомны, а молекулы таких веществ, как кислород, водород, азот, хлор, бром, состоят из двух атомов (рис. 34). Молекула фосфора содержит четыре атома, а серы — восемь (рис. 35).
Если вещества состоят из атомов одного вида, то они относятся к простым веществам.
Простыми называются вещества, которые образованы атомами одного химического элемента.
Простые вещества — одна из форм существования химических элементов в природе. Простые вещества, состоящие из молекул, относятся к веществам молекулярного строения. При обычных условиях среди них есть газы (водород, кислород, азот, фтор, хлор, благородные газы), жидкости (бром) и твердые вещества (сера, иод, фосфор).
Элемент кислород существует в виде двух простых веществ молекулярного строения: одно из них (просто кислород) состоит из двухатомных молекул, а второе (озон) — из трехатомных.
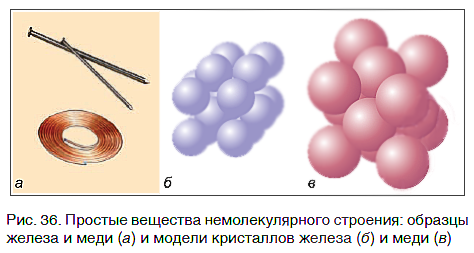
Связываясь друг с другом, атомы образуют не только молекулы. Гораздо больше простых веществ, которые имеют немолекулярное строение. Они обычно представляют собой твердые кристаллические вещества, построенные из атомов, например кристаллы алмаза, графита, меди, железа (рис. 36).
Простые вещества по их свойствам делят на металлы и неметаллы.
Все металлы при комнатной температуре являются твердыми веществами (за исключением ртути), которые проводят электрический ток и теплоту, имеют характерный металлический блеск. Многие из металлов пластичны, т. е. меняют свою форму при механическом воздействии. Благодаря этому свойству металлы можно ковать, расплющивать, вытягивать в проволоку.
Большинство простых веществ — металлы, и все они имеют немолекулярное строение.
 Хотя простых веществ неметаллов гораздо меньше, по своим свойствам они различаются между собой значительно сильнее, чем металлы. Почти все они плохо проводят электрический ток и теплоту. Многие из неметаллов при обычных условиях являются хрупкими твердыми веществами (рис. 37), другие — газами (рис. 38), а бром — жидкостью (рис. 39). Большинство неметаллов существует в виде молекул, но некоторые имеют немолекулярное строение, например бор, углерод, кремний.
Хотя простых веществ неметаллов гораздо меньше, по своим свойствам они различаются между собой значительно сильнее, чем металлы. Почти все они плохо проводят электрический ток и теплоту. Многие из неметаллов при обычных условиях являются хрупкими твердыми веществами (рис. 37), другие — газами (рис. 38), а бром — жидкостью (рис. 39). Большинство неметаллов существует в виде молекул, но некоторые имеют немолекулярное строение, например бор, углерод, кремний.
Алмаз и графит — это простые вещества, состоящие из атомов одного и того же химического элемента — углерода. Хотя они оба имеют немолекулярное строение, свойства этих веществ сильно отличаются: алмаз — прозрачное, самое твердое в природе вещество, а графит — темно-серое, непрозрачное, мягкое вещество (рис. 40). Их свойства различны потому, что различно строение их кристаллов, хотя состоят эти кристаллы из одних и тех же атомов — атомов углерода.

В настоящее время известно более 400 простых веществ, хотя элементов пока открыто только 118. Названия большинства простых веществ такие же, как и названия соответствующих химических элементов. Только у элемента углерода простые вещества (как вы уже знаете) имеют собственные названия, да еще у элемента кислорода есть простое вещество озон.
Необходимо различать понятия простое вещество и химический элемент, поскольку в большинстве случаев их названия совпадают.
Химический элемент — это определенный вид атомов. Поэтому название химического элемента — это то, что объединяет атомы данного вида. У всех таких атомов есть общие черты. Каждый химический элемент обозначается с помощью соответствующего химического знака.
В то же время понятие простое вещество обозначает конкретное химическое вещество, образованное атомами одного вида. Оно характеризуется определенными составом, строением, физическими и химическими свойствами.
Например, если говорят о том, что в состав какого-то вещества входит азот, то имеют в виду атомы этого химического элемента, а когда говорят об азоте, который входит в состав воздуха, то, конечно, речь идет о простом веществе.
Более подробно о различии понятий «простое вещество» и «химический элемент» вы узнаете в главах 2, 3.
Краткие выводы урока:
Надеюсь урок 3 «Молекулы и простые вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
В русском языке свыше сотни тысяч слов. Но все эти слова образуются сочетаниями всего 33 различных букв. В ходе этого урока вы узнаете, что, подобно тому, как из букв образуются слова, миллионы различных веществ образуются сочетаниями приблизительно сотни видов «кирпичиков». Эти сочетания образуют наименьшие частицы вещества, которые называются молекулами, а «кирпичики», из которых состоят молекулы, называются атомами.
Тема: Первоначальные сведения о строении вещества
Урок: Молекулы
Мы знаем, что все вещества состоят из частиц. Эти частицы непрерывно движутся, между ними есть промежутки, а сами частицы очень малы.
Вспомним опыт из предыдущего занятия. Мы взяли раствор красителя, перенесли в сосуд небольшую его долю и долили сосуд чистой водой. Весь объем жидкости в сосуде окрасился, но окраска стала слабее. Из этого сосуда мы перелили часть подкрашенной жидкости в следующий сосуд и опять долили чистой водой. И вновь весь объем жидкости оказался окрашенным.
Рис. 1. При многократном разбавлении раствора красителя водой окраска все равно сохраняется
Из данного опыта мы можем сделать вывод, что при каждом последующем разделении раствора количество частиц красителя в растворе становится все меньше и меньше. И тогда напрашивается вопрос: можно ли делить вещество (в нашем случае краситель) на части до бесконечности?
Ответ на поставленный нами вопрос предложил древнегреческий ученый Демокрит, живший в V веке до нашей эры.
Рис. 2. Демокрит – автор идеи о существовании предела деления вещества на части
Демокрит утверждал, что все вещества состоят из частиц. Самая мельчайшая частичка воды – молекула воды. Все молекулы воды абсолютно одинаковые. Самая мельчайшая частица сахара – молекула сахара. Все молекулы сахара также одинаковые. Их строение таково, что сахар на вкус сладкий. А строение молекул воды таково, что чистая вода сладкой не кажется. Сладкий вкус – одно из многих химических свойств молекул сахара.
Молекулой называется мельчайшая частица вещества, сохраняющая его химические свойства.
Все молекулы одного вещества одинаковы, молекулы разных веществ различны.
Кусочек сахара можно разломить на очень маленькие частички. Капля бензина или масла может растекаться по поверхности жидкости на очень большие площади. Толщина пленки при этом будет в несколько тысяч раз меньше толщины человеческого волоса. И даже мельчайшая частица сахара, и даже небольшой участок масляной пленки на поверхности воду будут содержать не одну, а огромное количество молекул.
Молекулы очень малы. Но даже они могут разделиться на еще более мелкие составные части. Они называются атомы. Слово «атом» ввел в употребление Демокрит. В переводе на русский язык оно означает «неделимый». Атомы – это «кирпичики», из которых строятся молекулы любого вещества. Различных сортов атомов около сотни. Каждый сорт атомов имеет свое общепринятое обозначение из одной или двух латинских букв.
Рис. 3. Каждый сорт атомов имеет свое название и принятое во всем мире обозначение
Атомы, соединяясь друг с другом, образуют молекулы. Так, если взять два атома водорода (обозначаются латинской буквой H) и один атом кислорода (обозначается буквой O), то при соединении этих атомов получится молекула воды. Ее химическое обозначение (химическую формулу), записывают так: h3O.
Рис. 4. Молекула воды получается при соединении двух атомов водорода и одного атома кислорода.
Все тела представляются нам сплошными. Это объясняется тем, что молекулы и тем более составляющие их атомы очень малы. И все же ученые придумали очень сложные приборы, позволяющие увидеть молекулы вещества и даже отдельные атомы. Одно из таких сложнейших устройств называется электронный микроскоп.
Рис. 5. Современный электронный микроскоп
Рис. 6. Изображение атомов углерода
Атомы – очень мелкие частицы. Но и они, несмотря на название, оказываются делимы. Атомы тоже состоят из еще более мелких частиц (удивительно, что этих частиц всего три сорта – электроны, протоны, нейтроны). Об их существовании, конечно, не было известно Демокриту. О внутреннем строении атома физики узнали только в начале ХХ столетия, а вам предстоит познакомиться в старшей школе.
В заключение урока уместно привести одну правдивую историю.
Корреспондент некой американской газеты спросил знаменитого физика Ричарда Фейнмана: «Господин Фейнман, если бы вдруг выяснилось, что в результате катастрофы все знания человечества должны погибнуть и Вам необходимо в одной фразе передать будущим поколениям самое ценное из них, то что бы Вы сказали потомкам?»
Ученый ответил так: «Безусловно, это была бы атомистическая гипотеза: весь мир состоит из мельчайших частиц, которые непрерывно движутся и взаимодействуют друг с другом».
Рис. 7. Ричард Фейнман (1918–1988) – один из крупнейших ученых, работавших над изучением физики микромира.
Список литературы
1. Перышкин А.В. Физика. 7 кл. – 14-е изд., стереотип. – М.: Дрофа, 2010.
2. Перышкин А.В. Сборник задач по физике, 7 – 9 кл.: 5-е изд., стереотип. – М: Издательство «Экзамен», 2010.
3. Лукашик В.И., Иванова Е.В. Сборник задач по физике для 7 – 9 классов общеобразовательных учреждений. – 17-е изд. – М.: Просвещение, 2004.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Единая коллекция Цифровых Образовательных Ресурсов (Источник).
2. Единая коллекция Цифровых Образовательных Ресурсов (Источник).
Домашнее задание
Лукашик В.И., Иванова Е.В. Сборник задач по физике для 7 – 9 классов №№ 41, 42.
mirror.vsibiri.info
Действительно, много не расскажешь.. . Размер атома водорода = ~1Ă, Диаметр молекулы фуллерена = ~1 нм Длина ДНК до 4 десятых миллиметра Может ещё про историю первых измерений и про современные методы - рентгеновский анализ и туннельный микроскоп рассказать?
Советую заглянуть поискать в учебнике примерно вот это: Определение что такое атом и молекула. Что атом - мельчайшая химчески неделимая частица и т. п. В чем измеряется размер молекул и атомов. Что рассмотреть атомы и молекулы стало возможным только после изобретения рентгена, что сейчас для этого используют электронные микроскопы. Что влияет на размер атома т. е. расказать о влиянии количества электронных уровней на радиус атома. Что молекулы крупнее атомов. Что молекулы бывают небольшими, как правило, это молекулы неорганических веществ. Что есть гигантские органические молекулы - полимеры, молекулы белков. Атомно-молекулярную теорию Ломоносова упомянуть. Фух, даже не знаю, что еще предложить, школа давно позади, по этому может чего и лишку для 7-го класса.
Размеры очень маленькие. Самый крошечный - атом водорода (или гелия) - имеет диаметр около 1 ангстрема - это в десять миллионов раз меньше миллиметра. Если бы молекулы (воды, например) были размером с футбольный мяч, человек имел бы рост 1,3 млн. км - это в три раза больше расстояния от Земли до Луны. А обычное яблоко было бы размером с Нептун. Размеры молекул можно оценить очень просто - капнуть масла на поверхность воды. Во сколько раз площадь маслянного пятна меньше капли, во столько раз и размер молекул меньше размеров капли.
Начните с того, что атомы ничтожно малы.. . что атомы образуют молекулы, но не наоборот.. а далее воспользуйтесь предыдущими ответами.
Мир молекул, атомов и их составляющих называют микромиром. Характеризуя чрезвычайно малые объекты микромира, для короткого записи ученые используют стандартный вид числа (запись числа в виде произведения a•10n, где 1 < a < 10, n — целое число, которое называют порядком числа). Размер атома примерно равен 0,000 000 0001 м, или 1 • 10-10 м. Размер молекулы примерно равен суммарным размерам всех атомов. Увидеть отдельные атомы и молекулы, можно под электронным микроскопом. Атом (в переводе с греческого это слово означает «неделимый») представляет собой ядро, окруженное легкими частицами — электронами (расстояние от ядра до электронов превышает размер ядра в 100 000 раз). Внутреннее строение атома наглядно описать невозможно, поэтому для объяснения процессов, происходящих в атоме, создано его физические модели (например планетарную модель атома). Электроны могут оставлять одни атомы и присоединяться к другим. Если атом потерял один или несколько электронов, то атом превращается в положительный ион. Если же к атому присоединились один или несколько электронов, то атом превращается в отрицательный ион.
touch.otvet.mail.ru
Данный видеоурок посвящен теме «Основные положения МКТ. Строение вещества. Молекула». Здесь вы узнаете, что изучает молекулярно-кинетическая теория (МКТ) в физике. Познакомитесь с тремя основными положениями, на которых базируется МКТ. Узнаете, чем определяются физические свойства вещества и что представляют собой атом и молекула.
Тема: Основы молекулярно-кинетической теорииУрок: Основные положения МКТ. Строение вещества. Молекула
Для начала давайте вспомним все предыдущие разделы физики, которые мы изучали, и поймём, что всё это время мы рассматривали процессы, происходящие с макроскопическими телами (или объектами макромира). Теперь же мы будем изучать их строение и процессы, протекающие внутри них.
Определение. Макроскопическое тело – тело, состоящее из большого числа частиц. Например: машина, человек, планета, бильярдный шар…
Микроскопическое тело – тело, состоящее из одной или нескольких частиц. Например: атом, молекула, электрон… (рис. 1)


Рис. 1. Примеры микро- и макрообъектов соответственно
Определив таким образом предмет изучения курса МКТ, следует теперь поговорить об основных целях, которые ставит перед собой курс МКТ, а именно:
Изучение этих вопросов, которое будет проходить на протяжении всей темы, начнётся сейчас с того, что мы сформулируем так называемые основные положения МКТ, то есть некоторые утверждения, истинность которых уже давно не подвергается сомнениям, и, отталкиваясь от которых, будет строиться весь дальнейший курс.
Разберём их по очереди:
Все вещества состоят из большого количества частиц – молекул и атомов.
Определение. Атом – мельчайшая частица химического элемента. Размеры атомов (их диаметр) имеет порядок  см. Стоит отметить, что различных типов атомов, в отличие от молекул, относительно немного. Все их разновидности, которые на сегодняшний день известны человеку, собраны в так называемой таблице Менделеева (см. рис. 2)
см. Стоит отметить, что различных типов атомов, в отличие от молекул, относительно немного. Все их разновидности, которые на сегодняшний день известны человеку, собраны в так называемой таблице Менделеева (см. рис. 2)

Рис. 2. Периодическая таблица химических элементов (по сути разновидностей атомов) Д. И. Менделеева
Молекула – структурная единица вещества, состоящая из атомов. В отличие от атомов, они больше и тяжелее последних, а главное, они обладают огромным разнообразием.
Вещество, молекулы которого состоят из одного атома, называются атомарными, из большего количества – молекулярными. Например: кислород, вода, поваренная соль ( ) – молекулярные; гелий серебро (He, Ag) – атомарные.
) – молекулярные; гелий серебро (He, Ag) – атомарные.
Причём следует понимать, что свойства макроскопических тел будут зависеть не только от количественной характеристики их микроскопического состава, но и от качественной.
 |
Если в строении атомов вещество имеет какую-то определённую геометрию (кристаллическую решётку), или же, наоборот, не имеет, то этим телам будут присущи различные свойства. Например, аморфные тела не имеют строгой температуры плавления. Самый известный пример – это аморфный графит и кристаллический алмаз. Оба вещества состоят из атомов углерода.


Рис. 3. Графит и алмаз соответственно
Таким образом «из скольких, в каком взаимном расположении и каких атомов и молекул состоит вещество?» - первый вопрос, ответ на который приблизит нас к пониманию свойств тел.
Все упомянутые выше частицы находятся в непрерывном тепловом хаотическом движении.
Так же, как и в рассматриваемых выше примерах, важно понимание не только количественных аспектов этого движения, но и качественных для различных веществ.
Молекулы и атомы твёрдых тел совершают лишь небольшие колебания относительно своего постоянного положения; жидких – также совершают колебания, но из-за больших размеров межмолекулярного пространства иногда меняются местами друг с другом; частички газа, в свою очередь, практически не сталкиваясь, свободно перемещаются в пространстве.
Частицы взаимодействуют друг с другом.
Взаимодействие это носит электромагнитный характер (взаимодействия ядер и электронов атома) и действует в обе стороны (как притягивание, так и отталкивание).

Здесь: d – расстояние между частицами; a – размеры частиц (диаметр).
Впервые понятие «атом» было введено древнегреческим философом и естествоведом Демокритом (рис. 4). В более поздний период активно задался вопросом о структуре микромира русский учёный Ломоносов (рис. 5).

Рис. 4. Демокрит

Рис. 5. Ломоносов
На следующем занятии мы введём методы качественного обоснования основным положениям МКТ.
Список литературы
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
Домашнее задание
mirror.vsibiri.info
Методические цели:
Образовательные: вызвать объективную необходимость изучения нового материала; способствовать овладению знаниями по теме «Строение вещества. Молекулы».
Развивающие: содействовать развитию речи, мышления, познавательных и общетрудовых умений; содействовать овладению методами научного исследования: анализа и синтеза.
Воспитательные: формировать добросовестное отношение к учебному труду, положительной мотивации к учению, коммуникативных умений; способствовать воспитанию гуманности, дисциплинированности, эстетического восприятия мира.
Тип урока: урок изучения нового материала.
Форма проведения: исследовательская работа, дискуссия.
Оборудование: УМК, ПК, слайды, тарелка с водой, подсолнечное масло, 2 сосуда с водой, пустой сосуд большего объема, акварельная краска.
Демонстрации:
Кусочек мела можно разломить, раздробить на маленькие кусочки, растереть в порошок.
Растворение марганцовки в воде.
Расширение стального шарика при нагревании.
1. Организационный этап.
Учитель: Здравствуйте. Прежде чем мы приступим к уроку, я хотел бы, чтобы каждый из вас настроился на рабочий лад. Просто расслабьтесь и скажите себе: «Я нахожусь сейчас на уроке физики. У меня хорошее настроение. У меня все получается». Прекрасно! А теперь давайте приступим к работе.
2. Этап активации учащихся.
Начнём урок с небольшого повторения ранее рассмотренных тем.
Какие из перечисленных явлений относятся к физическим?
1. Закипела вода в чайнике.
2. Прокисло молоко.
3. Горят дрова в печи.
4. Распустился подснежник.
5. Звенит звонок с урока. ( 1,5)
Выберите из перечисленного вещества.
1. Вода в стакане.
2. Снежный ком.
3. Железнодорожный рельс
4. Стекло.
5. Лист клёна. ( 4)
Что здесь лишнее?
1. Термометр.
2. Весы.
3. Насос.
4. Линейка.
5. Мензурка. ( 3)
3. Этап постановки целей и задач урока.
Проблемная ситуация: Физика изучает физические явления. Изучить – значит объяснить, почему так, а не иначе протекает данное явление. Вы ежедневно сталкиваетесь с различными физическими явлениями и в большинстве случаев можете точно сказать как они закончатся. Например, чем закончатся следующие события:
Если капнуть каплю краски в стакан с водой, то…
Если открыть флакон с духами, то…
Если нагреть лёд, то…
Если сжать два кусочка пластилина, то…
Если с силой ударить по стеклу, то…
Если опустить термометр в горячую воду, то…
Учитель: Итак, давая свои ответы, вы руководствовались определенными знаниями, которые вы получили на уроках естествознания и из житейского опыта. А теперь подумайте, сможете ли вы ответить на такие вопросы:
Почему одни тела твердые (стена, ручка), другие мягкие (пух, ткань)?
Почему вода растекается по поверхности стола, а книга нет?
Почему твердое тело трудно сжать, а газ легко?
Почему, если намочить классную доску, то скоро она вновь станет сухой (вода испарится), а сама доска не испаряется?
Почему все вещества обладают такими разными свойствами?
Чтобы ответить на эти и многие другие вопросы, надо знать строение вещества. Об этом мы и будем говорить на уроке. Цель, которую мы сегодня ставим перед собой – увидеть многое в малом, получить представление о внутреннем строении вещества.
4. Этап исследовательской работы учащихся.
I. Давайте наблюдать и делать выводы.
Демонстрации ( сопровождаются комментариями и диалогом с классом):
Кусочек мела можно разломить, раздробить на маленькие кусочки, растереть в порошок.
Растворение марганцовки в воде.
Расширение стального шарика при нагревании.
Какие выводы можем сделать?
1.Тела можно дробить на части.
2.Можно растворять.
3.Тела расширяются при нагревании.
Следовательно, можем предположить, что тела не являются сплошными, а состоят из частиц.
II. Возникают следующие вопросы:
Демонстрация: Продолжить опыт по растворению марганцовки, последовательно окрашивая новые порции воды.
Анализируя проведенный опыт с точки зрения ответов на эти вопросы, делаем выводы, что частицы очень маленькие и их в каждом теле очень много.
Обсудить результаты данных опытов. Еще раз убедиться в том, что сделанные предположения позволяют объяснить наблюдаемые явления.
III. Сейчас уже ученые точно установили, что все тела состоят из частиц, которые называют молекулами, что в переводе с древнегреческого языка означает «маленькая массочка».
5. Этап получения новых знаний.
Из истории вопроса. 25 веков назад, Древняя Греция.
Демокрит: тела только кажутся сплошными. Они состоят из частиц – атомов.
Но идея Демокрита считалась не верной 1000 лет. Сомнения породила химия. Химики обнаружили элементы (золото, ртуть, свинец), которые не разлагались на более простые. В дальнейшем было открыто множество таких элементов. К началу ХХ века были открыты почти все элементы, встречающиеся в природе. Но окончательно подтвердились эти идеи опытом только в ХХ веке, когда изобрели электронный микроскоп, который позволил увидеть молекулы.
Молекула - наименьшая частица данного вещества, характеризующая его свойства.
Можно ли молекулы делить на части?
Сложные опыты (о них будем говорить в старших классах и на уроках химии) показали, что молекулы делимы. Молекулы состоят из еще более маленьких частиц – атомов.
Атом- наименьшая частица элемента.
Например, молекула воды состоит из двух атомов водорода и одного атома кислорода. Обозначение молекулы воды Н2О.
(Рассмотреть рисунок 28 в учебнике на стр. 46)
Почему же именно молекула, а не атом считается наименьшей частицей вещества?
Именно молекула обладает свойствами данного вещества (речь идет о химических свойствах). Если будем последовательно делить воду на части и дойдем при этом до молекулы воды, то молекула – это еще вода. Если же разделим молекулу, то получим атомы, которые свойствами воды уже не обладают. Из этих же атомов состоят молекулы разных газов - кислорода (О2), водорода (Н2), свойства которых отличаются от свойств воды. Атомов в природе существует немного, около 100 и все они занесены в таблицу (показываем периодическую таблицу элементов Д.И. Менделеева). А молекул, которые состоят из этих атомов – великое множество. Попробуйте перечислить известные вам вещества!
Опыты показали, что молекулы одного и того же вещества одинаковы, независимо от того, каким способом получили данное вещество. То есть молекулы воды, водяного пара, льда одинаковы (состоят из одних и тех же атомов), т к это одно о то же вещество но в разных агрегатных состояниях. Молекулы разных веществ отличаются друг от друга составом атомов.
Однако разнообразие веществ объясняется не только соединением атомов различных элементов в молекулы. Можно получить различные вещества из атомов одного и того же элемента. Например: алмаз и графит ( стр. 31 учебника).
6. Физминутка.
7. Этап обобщения и закрепления нового материала.
Подведем промежуточные итоги.
Все вещества состоят из молекул. Молекула – мельчайшая частица данного вещества.
1. Очень маленькие и их в теле очень много.
2. Молекулы состоят из атомов.
3. Молекулы одного и того же вещества одинаковы.
Первичное закрепление.
Какие явления указывают на то, что все вещества состоят из молекул ?молекулы очень маленькие? молекул в теле очень много?
«Молекула вещества – мельчайшая частица данного вещества». Можно ли убрать слово «мельчайшая»? Как изменится смысл утверждения?
Почему мельчайшей частицей вещества считают молекулу, а не атом?
«Молекулы одного и того же вещества одинаковы». Можно ли опустить слова «одного и того же»?
Качественные задачи.
1. Рука золотой статуи в древнегреческом храме, которую целовали прихожане, за десятки лет заметно похудела. Священники в панике: кто-то украл золото? Или это чудо, знамение?
Объясните на основе новых знаний, что же произошло?
2. Износ обуви, углубления в ступенях древних лестниц, протирание локтей пиджаков, брюк... Не наводят ли эти будничные явления на глубокие научные размышления? На какие?
3. Вы делаете уроки. Из кухни доносится аппетитный запах жареной картошки... Как это могло произойти, согласно гипотезе Демокрита?
8. Повторение. Игра « Весы».
Необходимо составить верную пару.
Например:
120 000 000 = 1,2*108 0,000 0065 = 6,5*10-6
103*106= 109 107 : 10-3= 1010
9. Рефлексия.
Учитель: Что ж, наш урок подходит к завершению. В той атмосфере и обстановке, в которой мы сегодня работали, каждый из вас чувствовал себя по-разному. И сейчас мне бы хотелось, чтобы вы оценили, насколько внутренне комфортно ощущал себя на этом уроке, каждый из вас, все вместе как класс, и понравилось ли вам то дело, которым мы с вами сегодня занимались. Оцените своё внутреннее состояние в баллах от 0 до 10
Мне очень понравилось с вами работать.
10. Заключительный этап.
Решать загадки можно вечно.
Вселенная ведь бесконечна.
Спасибо всем нам за урок,
А главное, чтоб был он впр
11. Домашнее задание: § 14 Упр. 5( 2 ), ответить на вопросы после параграфа.
Творческое задание: Придумать один или несколько опытов, доказывающих, что между молекулами имеются промежутки, и доказывающих, что размеры молекул малы.
infourok.ru