Содержание
Занимательные опыты
Почему чернеют фруктовые ножи?!
Почему чернеют фруктовые ножи
Если добавить к какому-нибудь фруктовому соку раствор соли железа (раствор соли железа можно легко получить в домашних условиях, если в медный купорос опустить на полчаса, например, гвоздь или несколько кнопок, скрепок), то жидкость сразу потемнеет. Мы получим раствор слабых чернил. Фрукты содержат дубильную кислоту, которая с солью железа образует чернила.
Для того чтобы получить раствор соли железа дома, опустите гвоздь в раствор медного купороса и подождите минут десять. Потом слейте зеленоватый раствор. Полученный раствор сульфата железа (FeSO4) можно использовать в реакциях.
Чай тоже содержит дубильную кислоту. Раствор соли железа, добавленный в слабый раствор чая, изменить окраску чая на чёрную. Именно по этому не рекомендуется заваривать чай в металлическом чайнике!
Химические реакции с поваренной солью
Иногда поваренную соль специально йодируют, т. е. добавляют к ней иодиды натрия или калия. Делается это потому, что йод входит в состав различных ферментов в организме, и при его недостатке ухудшается работа щитовидной железы.
е. добавляют к ней иодиды натрия или калия. Делается это потому, что йод входит в состав различных ферментов в организме, и при его недостатке ухудшается работа щитовидной железы.
Растворы медного купороса с поваренной солью (зелёного цвета)
Обнаружить добавку достаточно просто. Нужно сварить крахмальный клейстер: четверть чайной ложки крахмала развести в стакане холодной воды, нагреть до кипения, кипятить пять минут и охладить. Клейстер значительно более чувствителен к йоду, чем сухой крахмал. Далее треть чайной ложки соли растворяют в чайной ложке воды, в полученный раствор добавляют несколько капель уксусной эссенции (или половину чайной ложки уксуса), половину чайной ложки перекиси водорода и через две-три минуты — несколько капель клейстера. Если соль была йодирована, то перекись водорода вытеснит свободный иод:
2I—+ Н2О2+2СН3СООН→ I2+2Н2О+2СН3СОО—,
который окрасит крахмал в синий цвет. (Опыт не получится, если для иодирования соли использовали KClO3 вместо KI).
(Опыт не получится, если для иодирования соли использовали KClO3 вместо KI).
Можно провести опыт с медным купоросом и поваренной солью. Здесь не будет происходить ни одна из вышеперечисленных реакций. Но реакция красивая… При смешивании купороса и соли наблюдайте образование красивого зелёного раствора тетрахлорокупрата натрия Na2[CuCl4]
Занимательные опыты с марганцовкой:
Растворите в воде несколько кристалликов перманганата калия и подождите некоторое время. Вы заметите, что малиновая окраска раствора (объясняемая наличием перманганат-ионов в растворе) постепенно станет более бледной, а затем и совсем исчезнет, на стенках же сосуда образуется коричневый налёт оксида марганца (IV):
4КMnО4+2Н2О→ 4MnO2+4КОН+3О2
Посуду, в которой вы проводили опыт, легко очистить от налёта раствором лимонной или щавелевой кислоты. Эти вещества восстанавливают марганец до степени окисления +2 и переводят его в растворимые в воде комплексные соединения. В тёмных склянках растворы перманганата калия могут сохраняться годами.
В тёмных склянках растворы перманганата калия могут сохраняться годами.
Многие считают, что перманганат калия хорошо растворим в воде. На самом деле растворимость этой соли при комнатной температуре (20 °С) составляет всего 6,4 г на 100 г воды. Однако раствор имеет настолько интенсивную окраску, что кажется концентрированным.
Если нагреть марганцовку до 200 0C, то перманганат калия превратится в тёмно-зелёный манганат калия (К2MnO4). При этом выделяется большое количество чистого кислорода, который можно собрать и использовать для других химических реакций.
Особенно быстро раствор марганцовки портится (распадается) в присутствии восстановителей. Например, восстановителем является этиловый спирт C2H5OH. Реакция марганцовки со спиртом протекает следующим образом:
2КMnO4+3C2H5OH→ 2KOH+2MnO2+3CH3CHO+2H2O.
Моющее средство из марганцовки:
Для того чтобы получить самодельное «моющее средство», надо смешать марганцовку с кислотой. Конечно, не со всякой. Некоторые кислоты могут сами окисляться; в частности, если взять соляную кислоту, из неё выделится ядовитый хлор:
Конечно, не со всякой. Некоторые кислоты могут сами окисляться; в частности, если взять соляную кислоту, из неё выделится ядовитый хлор:
2КMnO4+16HCl→ 2MnCl2+5Cl2+2KCl+8Н2О.
Так его часто и получают в лабораторных условиях. Поэтому для наших целей лучше использовать разбавленную (примерно 5-процентную) серную кислоту. В крайнем случае её можно заменить разбавленной уксусной кислотой — столовым уксусом. Возьмём примерно 50 мл (четверть стакана) раствора кислоты, добавим 1—2 г перманганата калия (на кончике ножа) и тщательно перемешаем деревянной палочкой. Затем промоем её под струёй воды и привяжем к концу кусок поролоновой губки. Вот этой «кисточкой» быстро, но аккуратно размажем окислительную смесь по загрязнённому участку раковины. Вскоре жидкость начнёт менять цвет на тёмно-вишнёвый, а затем — на коричневый. Значит, реакция окисления пошла полным ходом.
Здесь необходимо сделать несколько замечаний. Работать надо очень осторожно, чтобы смесь не попала на руки и одежду; хорошо бы надеть клеёнчатый фартук. И не следует медлить, так как окислительная смесь очень едкая и со временем «съедает» даже поролон. После использования поролоновую «кисть» нужно погрузить в заранее приготовленную банку с водой, промыть и выбросить. Во время подобной очистки раковины может появиться неприятный запах, издаваемый продуктами неполного окисления органических загрязнений на фаянсе и самой уксусной кислоты, поэтому помещение должно проветриваться.
Работать надо очень осторожно, чтобы смесь не попала на руки и одежду; хорошо бы надеть клеёнчатый фартук. И не следует медлить, так как окислительная смесь очень едкая и со временем «съедает» даже поролон. После использования поролоновую «кисть» нужно погрузить в заранее приготовленную банку с водой, промыть и выбросить. Во время подобной очистки раковины может появиться неприятный запах, издаваемый продуктами неполного окисления органических загрязнений на фаянсе и самой уксусной кислоты, поэтому помещение должно проветриваться.
Минут через 15—20 смоем побуревшую смесь струёй воды. И хотя раковина предстанет в ужасном виде — вся в бурых пятнах, волноваться не стоит: продукт восстановления перманганата калия — диоксид марганца MnO2 легко удалить, восстановив нерастворимый марганец (IV) до хорошо растворимой в воде соли марганца.
А вот когда перманганат калия взаимодействует с концентрированной серной кислотой, образуется оксид марганца (VII) Mn2О7 — маслянистая тёмно-зелёная жидкость. Это единственный жидкий при нормальных условиях оксид металла (tпл=5,9°С). Он очень неустойчив и легко взрывается при незначительном нагревании (tразл=55°С) или при сотрясении. Mn2О7 является ещё более сильным окислителем, чем КMnO4. При контакте с ним воспламеняются многие органические вещества, например этиловый спирт. Это, кстати, один из способов зажечь спиртовку, не имея спичек!
Это единственный жидкий при нормальных условиях оксид металла (tпл=5,9°С). Он очень неустойчив и легко взрывается при незначительном нагревании (tразл=55°С) или при сотрясении. Mn2О7 является ещё более сильным окислителем, чем КMnO4. При контакте с ним воспламеняются многие органические вещества, например этиловый спирт. Это, кстати, один из способов зажечь спиртовку, не имея спичек!
Занимательные опыты с перекисью водорода
Пероксид водорода может быть как окислителем (это его свойство широко известно), так и восстановителем! В последнем случае он реагирует с веществами-окислителями:
Н2О2-2е→ 2Н++О2. Диоксид марганца как раз и является таким веществом. Подобные реакции химики называют «восстановительным распадом пероксида водорода».
Вместо аптечной перекиси можно использовать таблетки гидроперита — соединения пероксида водорода с мочевиной состава CO(NH2)2•Н2О2. Это не химическое соединение, поскольку между молекулами мочевины и пероксида водорода нет химических связей; молекулы Н2О2 как бы включены в длинные узкие каналы в кристаллах мочевины и не могут выйти оттуда, пока вещество не растворят в воде. Поэтому такие соединения называют канальными соединениями включения. Одна таблетка гидроперита соответствует 15 мл (столовой ложке) 3-процентного раствора Н2О2. Для получения 1-процентного раствора Н2О2 берут две таблетки гидроперита и 100 мл воды.
Это не химическое соединение, поскольку между молекулами мочевины и пероксида водорода нет химических связей; молекулы Н2О2 как бы включены в длинные узкие каналы в кристаллах мочевины и не могут выйти оттуда, пока вещество не растворят в воде. Поэтому такие соединения называют канальными соединениями включения. Одна таблетка гидроперита соответствует 15 мл (столовой ложке) 3-процентного раствора Н2О2. Для получения 1-процентного раствора Н2О2 берут две таблетки гидроперита и 100 мл воды.
Используя диоксид марганца в качестве окислителя пероксида водорода, нужно знать одну тонкость. MnO2 — хороший катализатор реакции разложения Н2О2 на воду и кислород:
2Н2О2→ 2Н2О+О2.
И если просто обработать раковину раствором Н2О2, то он мгновенно «вскипит», выделяя кислород, а бурый налёт так и останется, ведь катализатор в ходе реакции и не должен расходоваться.
Чтобы избежать каталитического разложения Н2О2, нужна кислая среда. Здесь тоже подойдёт уксус. Сильно разбавим водой аптечную перекись, добавим немного уксуса и этой смесью протрём раковину. Произойдёт настоящее чудо: грязно-бурая поверхность засверкает белизной и станет как новая. А чудо случилось в полном соответствии с реакцией
MnO2+Н2О2+2Н+→ Mn2++2Н2О+О2.
Остаётся только смыть хорошо растворимую соль марганца струёй воды.
Таким же способом можно попробовать почистить загрязнённую алюминиевую сковороду: в присутствии сильных окислителей на поверхности этого металла образуется прочная защитная плёнка оксида, которая предохранит его от растворения в кислоте. А вот чистить подобным методом эмалированные изделия (кастрюли, ванны) не стоит: кислая среда медленно разрушает эмаль.
Для снятия налёта MnO2 можно использовать также водные растворы органических кислот: щавелевой, лимонной, винной и др. Причём специально подкислять их не понадобится — кислоты сами создают в водном растворе достаточно кислую среду.
Причём специально подкислять их не понадобится — кислоты сами создают в водном растворе достаточно кислую среду.
Занимательные опыты
Химическая реакция между йодидом калия и уксуснокислым в свинцом
«Золото» в колбе
Конечно, золото — не настоящее, но опыт красивый! Для Химической реакции нам потребуется растворимая соль свинца (подойдёт уксуснокислый синец (CH3COO)2Pb- соль образованная растворение свинца в уксусной кислоте) и соль йода (например, йодид калия KI).
Уксуснокислый свинец можно получить и в домашних условиях, опустив кусочек свинца в уксусную кислоту. Йодид калия иногда используют для травления электронных плат
Йодид калия и уксуснокислый в свинец — две прозрачные жидкости, по внешнему виду не отличаются от воды.
Начнём реакцию: к раствору йодида калия прилейте раствор уксуснокислого свинца. Соединяя две прозрачные жидкости наблюдаем образование золотисто-жёлтого осадка — йодида свинца PbI2, — эффектно!
Реакция протекает следующим образом:
(CH3COO)2Pb+KI→ CH3COOK+PbI2
Занимательные опыты с канцелярским клеем
Канцелярский клей — это не что иное, как жидкое с текло или его химическое название «силикат натрия» Na2SiO3
Можно сказать также — это соль натрия кремниевой кислоты.
Если добавить к силикатному клею раствор уксусной кислоты, в осадок выпадет нерастворимая кремниевая кислота — гидратированный оксид кремния:
Na2SiO3+2СН3СООН→ 2CH3COONa+H2SiO3.
Полученный осадок H2SiO3 можно высушить в духовке и развести разбавленным раствором водорастворимых чернил. В результате чернила осядут на поверхности оксида кремния, и смыть их не удастся.
Такое явление называется адсорбцией (от лат. ad — «на» и sorbeo — «поглощаю»)
Ещё один красивый занимательный опыт с жидким стеклом. Нам понадобятся медный купорос CuSO4, сульфат никеля NiS04, хлорид железа FeCl3. Сделаем химический аквариум.
В высокую стеклянную банку с силикатным клеем, разбавленным пополам водой, одновременно из двух стаканов выливают разбавленные водные растворы сульфата никеля и хлорида железа. В банке постепенно вырастают силикатные «водоросли» жёлто-зелёного цвета, которые, переплетаясь, опускаются сверху вниз. Теперь добавим в банку по каплям раствор медного купороса, заселим аквариум «морскими звёздами». Рост водорослей — это результат кристаллизации гидроксидов и силикатов железа, меди и никеля, которые образуются в результате обменных реакций.
Теперь добавим в банку по каплям раствор медного купороса, заселим аквариум «морскими звёздами». Рост водорослей — это результат кристаллизации гидроксидов и силикатов железа, меди и никеля, которые образуются в результате обменных реакций.
Занимательные опыты с йодом
Добавим к йодной настойке несколько капель перекиси водорода H2O2 и перемешаем. Через некоторое время из раствора выделится чёрный поблёскивающий осадок. Это кристаллический йод — плохо растворимое в воде вещество. Иод выпадает быстрее, если раствор немного подогреть горячей водой. Перекись нужна для того, чтобы окислить содержащийся в настойке иодид калия KI (его добавляют, с целью увеличить растворимость иода).
С плохой растворимостью иода в воде связана и другая его способность — экстрагироваться из воды жидкостями, состоящими из неполярных молекул (маслом, бензином и т.д.). В чайную ложку воды добавим несколько капель подсолнечного масла. Перемешаем и увидим, что масло с водой не смешивается. Если теперь туда капнуть две-три капли йодной настойки и сильно встряхнуть, то слой масла приобретёт тёмно-коричневую окраску, а слой воды — бледно-жёлтую, т.е. большая часть йода перейдёт в масло.
Если теперь туда капнуть две-три капли йодной настойки и сильно встряхнуть, то слой масла приобретёт тёмно-коричневую окраску, а слой воды — бледно-жёлтую, т.е. большая часть йода перейдёт в масло.
Йод — весьма едкое вещество. Чтобы убедиться в этом, несколько капель йодной настойки поместим на металлическую поверхность. Через некоторое время жидкость обесцветится, а на поверхности металла останется пятно. Металл прореагировал с иодом с образованием соли — йодида. На этом свойстве иода основан один из способов нанесения надписей на металл.
Цветной занимательный опыт с аммиаком
Под веществом «аммиак» мы подразумеваем водный раствор аммиака (нашатырный спирт). На самом же деле — аммиак — это газ, при растворении в воде который образует новый класс химических соединений — «основания». Именно с основанием мы и будем экспериментировать.
Эффектный опыт можно проделать с раствором аммиака (нашатырным спиртом). Аммиак образует с ионами меди окрашенное соединение. Возьмите бронзовую или медную монету с тёмным налётом и залейте её нашатырным спиртом. Сразу или через несколько минут раствор окрасится в синий цвет. Это под действием кислорода воздуха медь образовала комплексное соединение — аммиакат:
Возьмите бронзовую или медную монету с тёмным налётом и залейте её нашатырным спиртом. Сразу или через несколько минут раствор окрасится в синий цвет. Это под действием кислорода воздуха медь образовала комплексное соединение — аммиакат:
2Cu+8NH3+3Н2О+О2→ 2[Cu(NH3)4(H2O)2](OH)
Занимательные опыты: гашение извести
Гашение извести — это химическая реакция между оксидом кальция (СaO — негашеная известь) и водой. Она протекает следующим образом:
CaO + H2O→ Ca(OH)2.
Гидроксид кальция (Ca(OH)2) ещё называется известковым молоком .
Если через раствор гидроксида кальция пропустить углекислый газ (или подышать в трубочку через раствор), то выпадет белый нерастворимый осадок карбоната кальция:
Ca(OH)2 + CO2→ CaCO3 + H2O.
Эта реакция также является качественной реакцией на ионы кальция Ca+ в растворе.
Образующееся вещество — карбонат кальция — это всем известный мел (извёстка, цветные мелки)
Хамелеон — MEL Chemistry
Реагенты
Гидроксид кальция
Перманганат калия
Cульфат натрия
Глицерин
Безопасность
Общие правила безопасности
- Не допускайте попадания химических реагентов в глаза или рот.

- Не допускайте к месту проведения экспериментов людей без защитных очков, а также маленьких детей и животных.
- Храните экспериментальный набор в месте, недоступном для детей младше 10 лет.
- Помойте или очистите всё оборудование и оснастку после использования.
- Убедитесь, что все контейнеры с реагентами плотно закрыты и хранятся по правилам после использования.
- Убедитесь, что все одноразовые контейнеры правильно утилизированы.
- Используйте только оборудование и реактивы, поставляемые в наборе или рекомендуемые текущими инструкциями.
- Если вы использовали контейнер для еды или посуду для проведения экспериментов, немедленно выбросьте их. Они больше не пригодны для хранения пищи.

Информация о первой помощи
- В случае попадания реагентов в глаза тщательно промойте глаза водой, при необходимости держа глаз открытым. Немедленно обратитесь к врачу.
- В случае проглатывания реагентов промойте рот водой, выпейте немного чистой воды. Не вызывайте рвоту. Немедленно обратитесь к врачу.
- В случае вдыхания реагентов выведите пострадавшего на свежий воздух.
- В случае контакта с кожей или ожогов промывайте поврежденную зону большим количеством воды в течение 10 минут или дольше.
- В случае сомнений немедленно обратитесь к врачу. Возьмите с собой химический реагент и контейнер от него.
- В случае травм всегда обращайтесь к врачу.
Рекомендации для родителей
- Неправильное использование химических реагентов может вызвать травму и нанести вред здоровью.
 Проводите только указанные в инструкции эксперименты.
Проводите только указанные в инструкции эксперименты. - Данный набор опытов предназначен только для детей 10 лет и старше.
- Способности детей существенно различаются даже внутри возрастной группы. Поэтому родители, проводящие эксперименты вместе с детьми, должны по своему усмотрению решить, какие опыты подходят для их детей и будут безопасны для них.
- Родители должны обсудить правила безопасности с ребенком или детьми перед началом проведения экспериментов. Особое внимание следует уделить безопасному обращению с кислотами, щелочами и горючими жидкостями.
- Перед началом экспериментов очистите место проведения опытов от предметов, которые могут вам помешать. Следует избегать хранения пищевых продуктов рядом с местом проведения опытов. Место проведения опытов должно хорошо вентилироваться и находиться близко к водопроводному крану или другому источнику воды.
 Для проведения экспериментов потребуется устойчивый стол.
Для проведения экспериментов потребуется устойчивый стол. - Вещества в одноразовой упаковке должны быть использованы полностью или утилизированы после проведения одного эксперимента, т.е. после открытия упаковки.
Другие эксперименты
Аметист и лабрадор
Малахит и пирит
Испытаниe пламенем
Жиры
Пошаговая инструкция
В пластиковую пробирку аккуратно высыпьте всё содержимое баночки с KMnO4 (200 мг смеси сульфата натрия Na2SO4 с KMnO4, 1% содержание по массе).

Вылейте в пробирку содержимое баночки с насыщенным раствором гидроксида кальция Ca(OH)2 (5 мл).
Плотно закройте пробирку крышкой и перемешайте. Убедитесь, что вы получили прозрачный раствор.
Добавьте к получившемуся фиолетовому раствору 2 капли 10%-го водного раствора глицерина.
Плотно закройте пробирку и встряхните её.
Внимательно следите за раствором в пробирке! Наблюдайте изменение цвета хамелеона.
Ожидаемый результат
Две капли глицерина превращают фиолетовый раствор перманганата калия KMnO4 сначала в зелёный, а затем — в оранжевый.
Утилизация
Утилизируйте твёрдые отходы эксперимента вместе с бытовым мусором. Слейте растворы в раковину, промойте избытком воды.
Что произошло
Почему марганцовка меняет цвет?
Марганцовкой называют раствор перманганата калия KMnO4. Он имеет насыщенный фиолетовый цвет. Однако после добавления глицерина в этот раствор мы наблюдаем достаточно быстрое изменение окраски: пробирка превращается в хамелеона. Что же происходит?
Он имеет насыщенный фиолетовый цвет. Однако после добавления глицерина в этот раствор мы наблюдаем достаточно быстрое изменение окраски: пробирка превращается в хамелеона. Что же происходит?
В воде KMnO4 распадается на две заряженные частицы:
KMnO4 → K+ + MnO4—
Именно MnO4— отвечает за фиолетовое окрашивание раствора. Частица MnO4— взаимодействует с глицерином. Сначала получается зелёный MnO42-:
MnO4— → MnO42-;
а затем бурый MnO2:
MnO42 → MnO2.
Дополнение
Атом марганца Mn в KMnO4 имеет внушительный положительный заряд (+7). Mn+7 – это сильный окислитель, а значит, он очень хочет заполучить в своё владение электроны (e—). Обычно Mn+7 забирает себе сразу несколько электронов – так сильно он хочет ими «полакомиться». Однако условия нашей реакции подобраны так, чтобы «голодный» марганец не торопился и насыщался электронами постепенно. А глицерин выступает в роли заботливой домохозяйки, подающей марганцу электроны порция за порцией:
Однако условия нашей реакции подобраны так, чтобы «голодный» марганец не торопился и насыщался электронами постепенно. А глицерин выступает в роли заботливой домохозяйки, подающей марганцу электроны порция за порцией:
MnO4— + e— → MnO42-;
MnO42 + 2e— → MnO2;
MnO2 + 2e— → Mn2+.
Фиолетовый перманганат MnO4— (заряд марганца +7, Mn7+) получает электрон и становится зелёным манганатом MnO42- (заряд марганца +6, Mn6+). Глицерин «кормит» его двумя электронами, и манганат превращается в бурый диоксид марганца MnO2 (Mn4+). Диоксид марганца мог бы взять ещё два электрона и превратиться в бесцветный Mn2+. Однако в условиях нашей реакции MnO2 выпадает в осадок, и этого не происходит.
Реакции, в которых вещества обмениваются электронами, называются окислительно-восстановительными. Жадные до электронов атомы называются окислителями, а те из атомов, которые отдают свои электроны («кормят» окислителей), – восстановителями. В нашем случае марганец – это окислитель, а глицерин – восстановитель.
Жадные до электронов атомы называются окислителями, а те из атомов, которые отдают свои электроны («кормят» окислителей), – восстановителями. В нашем случае марганец – это окислитель, а глицерин – восстановитель.
Кстати, заряды у атомов, (например: +1 у K+, +7 у Mn+7 или -1 у Cl—) химики называют степенями окисления. Подробнее о них вы можете прочитать в описании эксперимента «Исчезающий йод».
Почему раствор поначалу синеет?
Если внимательно следить за хамелеоном, вы заметите, что через несколько секунд после добавления глицерина в раствор он приобретёт синюю окраску. Синий цвет образуется при смешении фиолетового (от перманганата MnO4—) и зелёного (от манганата MnO42-) растворов. Однако он достаточно быстро зеленеет – в растворе становится всё меньше MnO4— и больше MnO42-.
Дополнение
Учёным удалось обнаружить, в какой форме марганец способен окрашивать раствор в синий цвет. Это происходит, когда он образует гипоманганат-ион MnO43-. Здесь марганец находится в степени окисления +5 (Mn+5). Однако MnO43- очень неустойчив, и для его получения необходимы особые условия, поэтому в нашем опыте его увидеть не получится.
Это происходит, когда он образует гипоманганат-ион MnO43-. Здесь марганец находится в степени окисления +5 (Mn+5). Однако MnO43- очень неустойчив, и для его получения необходимы особые условия, поэтому в нашем опыте его увидеть не получится.
Что происходит с глицерином в нашем опыте?
Глицерин взаимодействует с перманганатом калия, отдавая ему свои электроны. Глицерин взят в нашей реакции в большом избытке (его примерно в 10 раз больше, чем перманганата калия KMnO4). Сам глицерин в условиях нашей реакции превращается глицериновый альдегид, а затем − в глицериновую кислоту.
Дополнение
Как мы уже выяснили, глицерин C3H5(OH)3 окисляется перманганатом калия. Глицерин – это весьма сложная органическая молекула, поэтому и реакции с его участием зачастую непросты. Окисление глицерина – сложная реакция, в ходе которой образуется много различных веществ. Многие из них существуют совсем недолго и превращаются в другие, а некоторые можно найти в растворе и после окончания реакции. Такая ситуация характерна для всей органической химии в целом. Обычно те вещества, которых по итогам химической реакции получается больше всего, называют основными продуктами, а остальные – побочными.
Такая ситуация характерна для всей органической химии в целом. Обычно те вещества, которых по итогам химической реакции получается больше всего, называют основными продуктами, а остальные – побочными.
В нашем случае основной продукт окисления глицерина перманганатом калия – это глицериновая кислота.
Для чего мы добавляем гидроксид кальция Ca(OH)
2 в раствор KMnO4?
В водном растворе гидроксид кальция Ca(OH)2 распадается на три заряженные частицы (ионы):
Ca(OH)2 → Ca2+(раствор) + 2OH—.
В транспорте, магазине, кафе или в школьном классе – везде нас окружают разные люди. И ведём мы себя в таких местах по-разному. Даже если делаем одно и то же дело – например, читаем книгу. В окружении разных людей мы делаем это немного по-разному: где-то медленнее, где-то быстрее, иногда запоминаем прочитанное хорошо, а другой раз не можем вспомнить и строчки уже на следующий день. Так и перманганат калия в окружении ионов OH— ведёт себя по-особенному. +7 (в перманганате MnO4—) в Mn2+:
+7 (в перманганате MnO4—) в Mn2+:
MnO4— + 5e— → Mn2+
Последний (Mn2+) не придаёт воде никакой окраски. Поэтому в кислом растворе марганцовка очень быстро обесцветится, и хамелеон не получится.
Похожая ситуация произойдёт и в случае нейтрального раствора перманганата калия. Только мы «потеряем» не все цвета хамелеона, как в кислом растворе, а только два – зелёный манганат MnO42- получаться не будет, а значит, синее окрашивание тоже исчезнет.
Можно ли сделать хамелеона, используя что-нибудь, кроме KMnO
4?
Можно! Хамелеон из хрома (Cr) будет иметь следующую окраску:
оранжевый (бихромат Cr2O72-) → зелёный (Cr3+) → голубой (Cr2+).
Ещё один хамелеон – из ванадия (V):
жёлтый (VO3+) → голубой (VO2+) → зелёный (V3+) → лиловый (V2+).
Вот только заставить растворы соединений хрома или ванадия менять свой цвет так красиво, как это происходит в случае марганца (марганцовки), намного сложнее. Кроме того, придётся постоянно добавлять новые вещества в смесь. Поэтому настоящий хамелеон − такой, что будет менять свой цвет «самостоятельно», − получается только из марганцовки.
Дополнение
Марганец Mn, как и хром Cr и ванадий V, – это переходные металлы – большая группа химических элементов, обладающих целым набором интересных свойств. Одна из особенностей переходных металлов – яркая и разнообразная окраска соединений и их растворов.
Например, из растворов соединений переходных металлов легко получить химическую радугу:
Каждый Охотник Желает Знать, Где Сидит Фазан:
Красный (тиоционат железа (III) Fe(SCN)3), железо Fe;
Оранжевый (бихромат Cr2O72-), хром Cr;
Жёлтый (VO3+), ванадий V;
Зелёный (нитрат никеля, Ni(NO3)2), никель Ni;
Голубой (сульфат меди, CuSO4), медь Cu;
Синий (тетрахлоркобальтат, [CoCl4]2-), кобальт Co;
Фиолетовый (перманганат MnO4—), марганец Mn.

Развитие эксперимента
Как изменить хамелеона дальше?
Это интересно
Превращение «красного вина» в «воду» | Эксперимент
- Пять из пяти
Используйте подкисленный перманганат калия — или «красное вино» — для приготовления «воды», «молока» и «лимонада» в этой увлекательной демонстрации
В этом эксперименте учащиеся наблюдают за раствором подкисленного перманганата калия (VII) (‘ красное вино») наливают в набор стаканов, содержащих небольшое количество различных бесцветных растворов, состоящих из хлорида бария, тиосульфата натрия, карбоната натрия и серной кислоты. Едва заметные на расстоянии, эти бесцветные растворы вступают в реакцию с перманганатом калия (VII), создавая иллюзию превращения красного вина в молоко, малиновый молочный коктейль и шипучий лимонад.
Едва заметные на расстоянии, эти бесцветные растворы вступают в реакцию с перманганатом калия (VII), создавая иллюзию превращения красного вина в молоко, малиновый молочный коктейль и шипучий лимонад.
Источник: Королевское химическое общество. день, предназначенный для всех возрастных групп, в то время как в классе продвинутых учеников можно было попросить написать уравнения для вовлеченных реакций.
Демонстрация длится около 5 минут, но на предварительную подготовку требуется около 20–30 минут.
Оборудование
Аппаратура
- Защита глаз
- Бутылка для вина или фруктового сока, 750 см 3 или больше
- Бокалы для вина (или аналогичные), 5 шт. (см. примечание 8 ниже)
- Химические стаканы или конические колбы, 250 см 3
- Химический стакан или коническая колба, 1 дм 3
- Мерные цилиндры, 10 см 3
Химические вещества
- Перманганат калия(VII) (ОКИСЛЯЮЩИЙ, ВРЕДНЫЙ), 0,4 г
- Дигидрат хлорида бария (ТОКСИЧЕСКИЙ), 24 г
- Тиосульфат натрия-5-вода, 25 г
- Карбонат натрия (безводный) (РАЗДРАЖАЮЩЕЕ СРЕДСТВО), 22 г
- Разбавленная серная кислота, 2 М (КОРРОЗИОННОЕ), 100 см 3
- Вода деионизированная или дистиллированная, 1,5 дм 3
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.

- Всегда используйте защитные очки (растворы ТОКСИЧНЫ).
- Перманганат калия(VII), KMnO 4 (s), (ОКИСЛЕНИЕ, ВРЕДНО) – см. карточку опасности CLEAPSS HC081.
- Дигидрат хлорида бария, BaCl 2 .2H 2 O(s), (ТОКСИЧЕСКИЙ) – см. карту опасности CLEAPSS.
- Тиосульфат натрия-5-вода, Na 2 S 2 O 3 .5H 2 O(s) – см. карту опасности CLEAPSS.
- Карбонат натрия (безводный), Na 2 CO 3 (s), (РАЗДРАЖАЮЩЕЕ СРЕДСТВО) – см. карточку опасности CLEAPSS.
- Разбавленная серная кислота, H 2 SO 4 (водн.), (КОРРОЗИОННОЕ ВЕЩЕСТВО в используемой концентрации), 100 см 3 – см. карту опасностей CLEAPSS и книгу рецептов CLEAPSS.
- Другие типы стекла или даже мензурки можно использовать вместо фужеров, но эффект «вина» в «воду» явно уменьшится.
- Не оставляйте растворы в стаканах или бутылках после демонстрации, чтобы их не приняли за настоящие напитки! Утилизируйте содержимое НЕМЕДЛЕННО после демонстрации.

Процедура
Перед демонстрацией
- Приготовьте следующие четыре раствора:
- 24 г дигидрата хлорида бария в 100 см 3 деионизированной воды (около 1 М, ТОКСИЧНО).
- 25 г тиосульфата натрия в 100 см 3 деионизированной воды (это примерно 1 М).
- 21 г карбоната натрия в 100 см 3 деионизированной воды (это примерно 2 М, РАЗДРАЖАЮЩЕЕ).
- 0,4 г перманганата калия(VII), растворенного в 100 см 3 2 М серной кислоты, а затем доводят до 1 дм 3 водой деионизированной. Это дает раствор примерно 0,0025 М , который затем можно перелить в винную бутылку.
- Выровняйте пять стаканов на скамейке. Ни один из объемов или концентраций не должен быть слишком точным — относительно небольшие объемы жидкости почти наверняка не будут замечены аудиторией. Вне поля зрения зрителей (заранее):
- Оставить первое пустым.
- Поместите около 1 см 3 раствора тиосульфата натрия во вторую.

- Поместите около 1 см 3 раствора тиосульфата натрия и 3 см 3 раствора хлорида бария в третью.
- Поместите 3 см 3 раствора хлорида бария в четвертую.
- Поместите 1 см 3 раствора тиосульфата натрия и 3 см 3 раствора карбоната натрия в пятую.
Демонстрация
- Подходящим темпом налейте в каждый стакан по стакану раствора перманганата из винной бутылки. Не превышайте 200 см 3 для любого стакана, чтобы реагенты, уже находящиеся в стаканах, оставались в избытке.
- Будут видны следующие изменения:
- Стакан 1: без изменений.
- Стакан 2: «красное вино» превратилось в «воду» или «белое вино».
- Стакан 3: «красное вино» превратилось в «молоко».
- Стакан 4: «красное вино» превратилось в «малиновый молочный коктейль».
- Стакан 5: «красное вино» превратилось в «шипучий лимонад».

Учебные заметки
«Напитки» лучше всего удалять довольно быстро, так как стаканы 2 и 5 могут постепенно помутнеть из-за образования коллоидной серы из избытка тиосульфата и кислоты, а белые осадки в стаканах 3 и 4 осядут. , разрушая иллюзию.
Протекающие реакции кратко описаны ниже.
Стекло 2
Пурпурные ионы перманганата(VII) восстанавливаются до бесцветных ионов Mn 2+ – «вода» или «белое вино».
2MNO 4 — (AQ) + 16H + (AQ) + 10S 2 O 3 2– (AQ) → 2MN 2 (AQ) + 5S + 5S + 5S + 5S (AQ) + 5S (AQ) + 5S (AQ) + 4. 40085. O 6 2– (водн.) + 8H 2 O(ж)
Стекло 3
Ионы пурпурного перманганата(VII) восстанавливаются, как описано выше, и ионы бария образуют нерастворимый сульфат бария с присутствующими ионами сульфата в кислоте, используемой для приготовления раствора перманганата калия (VII), отсюда и иллюзия «молока».
Ba 2+ (водн.) + SO 4 2– (водн.) → BaSO 4 (тв.)
Стекло 4
остается перманганат калия(VII) – «малиновый молочный коктейль».
Стекло 5
Пурпурные ионы перманганата(VII) восстанавливаются, как указано выше, а ионы карбоната реагируют с ионами водорода, присутствующими в подкисленном растворе, с образованием диоксида углерода – «шипучий лимонад»
CO 3 2– (водн.) + 2H + (водн.) → H 2 O(л) + CO 2 (г)
На основе этого или другие системы. Например, изменение количества тиосульфата в стакане 5 таким образом, чтобы перманганат оказался в небольшом избытке, дает «розовое шампанское».
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
© Фонд Наффилда и Королевское химическое общество
Проверка здоровья и безопасности, 2016 г.
- Пять из пяти
Когда кристалл перманганата калия помещают в химический стакан, его пурпурный цвет распространяется по всему …
Перейти к
- Материя в нашем окружении — упражнение
- Материя в нашем окружении
- Чиста ли окружающая нас материя?
- Атомы и молекулы
Главная >
Лахмир Сингх
Класс 9
Химия
>
Глава 1.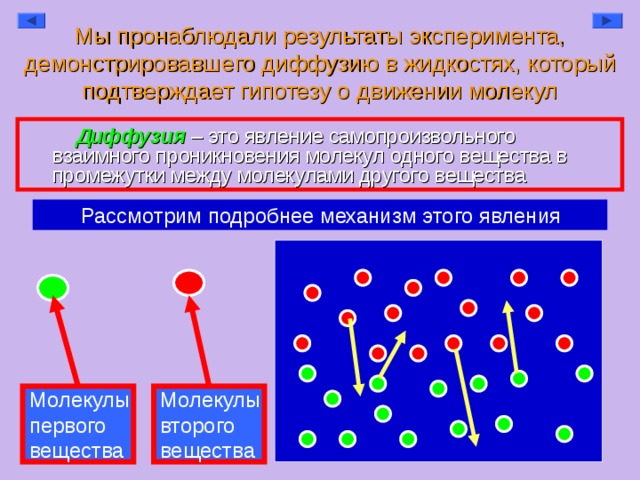 Материя в нашем окружении
Материя в нашем окружении
>
Материя в нашем окружении — упражнение
>
Вопрос 28
Вопрос 28 Материя в нашем окружении — Упражнение
Когда кристалл перманганата калия помещают в химический стакан, его пурпурный цвет распространяется по всей воде. Что это наблюдение говорит нам о природе перманганата калия и воды?
Ответ:
Фиолетовый цвет распространяется по всей воде, потому что кристалл перманганата калия состоит из множества мелких частиц, между которыми есть промежутки между этими частицами воды.
Связанные вопросы
Каково научное название частиц, из которых состоит материя?
**Каковы условия для того, чтобы «что-то» называлось «материей»?**
Кусок мела можно разбить на мелкие частицы ударом молотка, но кусок железа нельзя сломать.



 Проводите только указанные в инструкции эксперименты.
Проводите только указанные в инструкции эксперименты. Для проведения экспериментов потребуется устойчивый стол.
Для проведения экспериментов потребуется устойчивый стол.




