Содержание
Три опыта с марганцовкой — tavika.ru
для детей | опыты | химия | эксперименты
АвторТатьяна Пироженко
Продолжаем наши “Химические опыты с лекарствами из аптечки“. Следующее наше “подопытное” вещество – марганцовка. Это бытовое название. А химики называют это вещество перманганат калия или марганцовокислый калий, калиевая соль марганцовой кислоты. Химическая формула KMnO4
Раньше она свободно продавалась в аптеках. И лично мы для опытов пользуемся еще чуть ли не советской баночкой с порошком. Ведь для приготовления растворов его нужно совсем чуть-чуть, буквально несколько кристалликов!
Сейчас марганцовку в аптеке не продают, но ее можно купить в садоводческих магазинах как средство борьбы с болезнями растений.
Почему она оказалась у нас в аптечке?
Дело в том, что марганцовка – прекрасное антисептическое средство. Несколько капель раствора марганцовки можно добавить в воду в аквариуме, чтобы избавиться от его цветения и вылечить рыб от грибковых заболеваний. А еще ею можно обеззаразить почву перед посадкой растений, удобрить землю, замочить в растворе семена или опрыскать растения против грибковых и бактериальных болезней.
Несколько капель раствора марганцовки можно добавить в воду в аквариуме, чтобы избавиться от его цветения и вылечить рыб от грибковых заболеваний. А еще ею можно обеззаразить почву перед посадкой растений, удобрить землю, замочить в растворе семена или опрыскать растения против грибковых и бактериальных болезней.
Да и многие люди продолжают ею лечиться.
Но мы народные рецепты пробовать на себе не будем, а лучше поэкспериментируем с химическими веществами 🙂
К тому же помните, что марганцовка – сильный окислитель. Очень сильный!
Поэтому будьте с ней осторожны!
Реакции с большинством восстановителей (сахарозой, танинами, глицерином и многими другими) происходит так бурно, что идет нагрев, возможно самовозгорание и даже взрыв! При соприкосновении с соляной кислотой тоже будет взрыв.
И еще – очень опасно растирание сухого перманганата калия с органическими веществами и порошками активных металлов и неметаллов (кальцием, алюминием, магнием, фосфором, серой и др. ). Тоже может все взорваться.
). Тоже может все взорваться.
Понимаете теперь, почему марганцовку перестали продавать в аптеках?
Так что объясните это старшим детям, если они уже самостоятельно пользуются набором типа “Юный химик”. Там есть и перманганат калия, и разные кислоты, и порошки. Напомните им, что не понимая сути химических реакции и не зная пропорций НЕЛЬЗЯ бездумно смешивать все подряд!
Но те опыты, которые я привела в этом посте, совершенно безопасны. Их запросто можно делать вместе с детьми. Конечно, соблюдая при этом технику безопасности.
Опыт 13. Марганцовка и свет
Понадобится:
- розовый раствор марганцовки – 0,5 стакана воды и кристаллы марганцовки на кончике ножа.
Ход эксперимента:
1. Налейте немного раствора в два одинаковых чистых прозрачных стакана или пробирки.
2. Одну поставьте в темный шкаф для последующего сравнения.
3. А второй поставьте на яркий солнечный свет.
4. Через 3-4 дня достаньте раствор из шкафа и сравните его цвет со второй половиной.
Результат: Примерно на третьи сутки раствор, который был на свету, приобретет буро-оранжевый цвет. А раствор, который стоял в темноте, останется розовым.
Объяснение: Водный раствор перманганата калия очень неустойчив. Под действием солнечных лучей он разложился с образованием бурого осадка диоксида марганца. Свет только ускорил реакцию – постепенно разложится и станет оранжевой и вторая половина раствора. Если хотите на это посмотреть, оставьте марганцовку стоять в шкафу еще несколько дней.
Опыт 14. Марганцовка, меняющая цвет от “Крота”
Понадобится:
- раствор марганцовки из прошлого опыта
- гидроксид натрия (едкий натр – средство для прочистки труб “Крот”)
- чистый стакан
Ход эксперимента:
1. Налейте в чистый стакан раствор марганцовки и разбавьте его водой до очень бледного цвета (как на фото). Чтобы изменения цвета были видны.
2. Добавьте в марганцовку столько же раствора “Крота” и поставьте стакан спокойно постоять.
3. Подождите 5 минут. Жидкость станет фиолетовой.
4. Подождите еще 20 минут – раствор станет зеленым!
Результат: Розовая жидкость сначала станет фиолетовой, а потом зеленой!
Опыт 15. Радужная марганцовка с сахаром
Понадобится:
- раствор марганцовки с водой – 50 г
- гидроксид натрия (средство для прочистки труб “Крот”) – 50 г
- 1 ч.л. сахара без горки
- чистый стакан
Ход эксперимента:
1. Налейте в чистый стакан раствор “Крота”, насыпьте в него сахар и перемешайте до растворения – у нас получилась бесцветная жидкость.
2. А теперь приготовьтесь – изменения будут идти быстро. Буквально 3 секунды на всё!
Готовы наблюдать?
Тогда долейте в стакан к бесцветной жидкости розовый раствор марганцовки.
Что произойдет – смотрите на моем видео!
Результат: Розовая жидкость за несколько секунд сначала станет сине-фиолетовой, потом зеленой, а потом оранжевой!
Объяснение: Марганцовка окислила сахар в щелочной среде, и образовался оранжевый диоксид марганца.
Ссылки на другие наши о опыты с лекарствами вы найдете в заглавном посте “Химические опыты и эксперименты с лекарствами для детей”.
А вот здесь еще: 🎨 Цветные опыты по химии (получаем разноцветные жидкости в результате химических реакций), 🔮“Волшебное зелье” (опыты по смешению жидкостей разного цвета и плотности) и 🔥 Цветной огонь (химические опыты с окрашиванием пламени)
для детей | игры для обучения чтению | развивающие занятия | скачать
Пазл для чтения – карточки для распечатки
Чтобы побудить Катю больше читать, я стараюсь разнообразить игры со словами. У нас есть сделанные с этой целью разнообразные игры: Презентация “Букварь”, Алфавит в фотографиях,…
Читать далее Пазл для чтения – карточки для распечаткиПродолжить
ДИФФУЗИЯ ВЕЩЕСТВ
- Авторы
- Руководители
- Файлы работы
- Наградные документы
Литовченко Ю.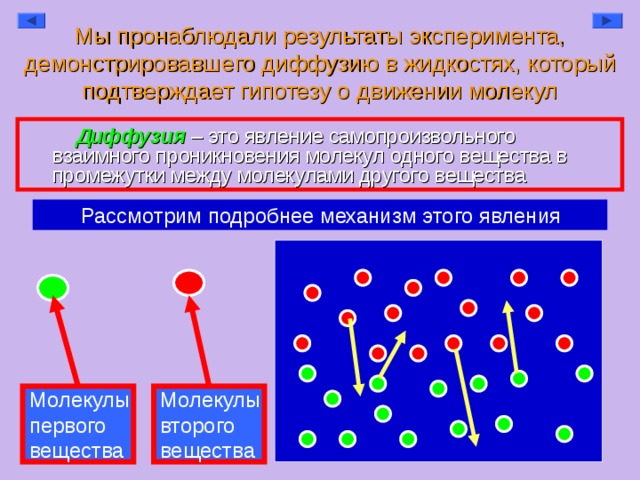 Е. 1
Е. 1
1
Кошевая И.Н. 1
1
Автор работы награжден дипломом победителя III степени
Диплом школьникаСвидетельство руководителя
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
Введение
Диффузия играет огромную роль в природе, в быту человека и в технике [2]. Диффузионные процессы могут оказывать как положительное, так и отрицательное влияние на жизнедеятельность человека и животных. Примером положительного воздействия является поддержание однородного состава атмосферного воздуха вблизи поверхности Земли. Диффузия играет важную роль в различных областях науки и техники, в процессах, происходящих в живой и неживой природе. Она оказывает влияние на течение химических реакций.
С участием диффузии или при нарушении и изменении этого процесса могут протекать отрицательные явления в природе и жизни человека, такие как обширное загрязнение окружающей среды продуктами технического прогресса человека.
Актуальность: Диффузия доказывает, что тела состоят из молекул, которые находятся в беспорядочном движении; диффузия имеет большое значение в жизни человека, животных и растений, а также в технике.
Цель:
доказать, что диффузия зависит от температуры;
рассмотреть примеры диффузии в домашних опытах;
убедиться, что диффузия в разных веществах происходит по-разному.
Рассмотреть тепловую диффузию веществ.
Задачи исследования:
Изучить научную литературу по теме «Диффузия».
Доказать зависимость скорости диффузии от рода вещества, температуры.
Изучить влияние явления диффузии на окружающую среду и человека.
Описать и спроектировать наиболее интересные опыты по диффузии.
Методы исследования:
Анализ литературы и материалов интернета.
Проведение опытов по изучению зависимости диффузии от рода вещества и температуры.
Анализ результатов.
Предмет исследования: явление диффузии, зависимость протекания диффузии от различных факторов, проявление диффузии в природе, технике, быту.
Гипотеза: диффузия имеет большое значение для человека и природы.
1.Теоретическая часть
1.1.Что такое диффузия
Диффузия — это самопроизвольное перемешивание соприкасающихся веществ, происходящее вследствие хаотического (беспорядочного) движения молекул.
Еще одно определение: диффузия (лат. diffusio — распространение, растекание, рассеивание) — процесс переноса материи или энергии из области с высокой концентрацией в область с низкой концентрацией [7].
Самым известным примером диффузии является перемешивание газов или жидкостей (если в воду капнуть чернил, то жидкость через некоторое время станет равномерно окрашенной).
Диффузия происходит в жидкостях, твердых телах и газах. Наиболее быстро диффузия происходит в газах, медленнее в жидкостях, ещё медленнее в твёрдых телах, что обусловлено характером теплового движения частиц в этих средах. Траектория движения каждой частицы газа представляет собой ломаную линию, т.к. при столкновениях частицы меняют направление и скорость своего движения. Столетиями рабочие сваривали металлы и получали сталь нагреванием твердого железа в атмосфере углерода, не имея ни малейшего представления о происходящих при этом диффузионных процессах. Лишь в 1896г. началось изучение проблемы.
Наиболее быстро диффузия происходит в газах, медленнее в жидкостях, ещё медленнее в твёрдых телах, что обусловлено характером теплового движения частиц в этих средах. Траектория движения каждой частицы газа представляет собой ломаную линию, т.к. при столкновениях частицы меняют направление и скорость своего движения. Столетиями рабочие сваривали металлы и получали сталь нагреванием твердого железа в атмосфере углерода, не имея ни малейшего представления о происходящих при этом диффузионных процессах. Лишь в 1896г. началось изучение проблемы.
Диффузия молекул протекает очень медленно. Например, если кусочек сахара опустить на дно стакана с водой и воду не перемешивать, то пройдёт несколько недель, прежде чем раствор станет однородным.
1.2. Роль диффузии в природе
С помощью диффузии происходит распространение различных газообразных веществ в воздухе: например, дым костра распространяется на большие расстояния [1]. Если посмотреть на дымовые трубы предприятий и выхлопные трубы автомобилей, во многих случаях вблизи труб виден дым. А потом он куда–то исчезает. Дым растворяется в воздухе за счет диффузии. Если же дым плотный, то его шлейф тянется довольно далеко.
Если посмотреть на дымовые трубы предприятий и выхлопные трубы автомобилей, во многих случаях вблизи труб виден дым. А потом он куда–то исчезает. Дым растворяется в воздухе за счет диффузии. Если же дым плотный, то его шлейф тянется довольно далеко.
Результатом диффузии может быть выравнивание температуры в помещении при проветривании. Таким же образом происходит загрязнение воздуха вредными продуктами промышленного производства и выхлопными газами автомобилей. Природный горючий газ, которым мы пользуемся дома, не имеет ни цвета, ни запаха. При утечке заметить его невозможно, поэтому на распределительных станциях газ смешивают с особым веществом, обладающим резким, неприятным запахом, который легко ощущается человеком даже при весьма малой его концентрации [2]. Такая мера предосторожности позволяет быстро заметить накопление газа в помещении, если образовалась утечка (рис 1).
Благодаря явлению диффузии нижний слой атмосферы – тропосфера – состоит из смеси газов: азота, кислорода, углекислого газа и паров воды [3]. При отсутствии диффузии произошло бы расслоение под действием силы тяжести: внизу оказался бы слой тяжёлого углекислого газа, над ним – кислород, выше – азот, инертные газы (рис 2).
При отсутствии диффузии произошло бы расслоение под действием силы тяжести: внизу оказался бы слой тяжёлого углекислого газа, над ним – кислород, выше – азот, инертные газы (рис 2).
В небе мы тоже наблюдаем это явление. Рассеивающиеся облака – тоже пример диффузии и как точно об этом сказано у Ф.Тютчева: «В небе тают облака…» (рис 3)
На принципе диффузии основано перемешивание пресной волы с солёной при впадении рек в моря. Диффузия растворов различных солей в почве способствует нормальному питанию растений.
Диффузия играет большую роль в жизни растений и животных. Муравьи помечают свой путь капельками пахучей жидкости и узнают дорогу домой (рис 4)
Благодаря диффузии, насекомые находят себе пищу. Бабочки, порхая меж растений, всегда находят дорогу к красивому цветку. Пчёлы, обнаружив сладкий объект, штурмуют его своим роем. А растение растет, цветет для них тоже благодаря диффузии. Ведь мы говорим, что растение дышит и выдыхает воздух, пьёт воду, получает из почвы различные микродобавки [2].
А растение растет, цветет для них тоже благодаря диффузии. Ведь мы говорим, что растение дышит и выдыхает воздух, пьёт воду, получает из почвы различные микродобавки [2].
Плотоядные животные находят своих жертв тоже благодаря диффузии. Акулы чувствуют запах крови на расстоянии нескольких километров, также как и рыбы пираньи (рис 5).
Большую роль играют диффузионные процессы в снабжении кислородом природных водоёмов и аквариумов. Кислород попадает в более глубокие слои воды в стоячих водах за счёт диффузии через их свободную поверхность. Так, например, листья или ряска, покрывающие поверхность воды, могут совсем прекратить доступ кислорода к воде и привести к гибели её обитателей. По этой же причине сосуды с узким горлом непригодны для использования в качестве аквариума (рис 6).
Уже было отмечено, что есть много общего в значении явления диффузии для жизнедеятельности растений и животных. Прежде всего, следует отметить роль диффузионного обмена через поверхность растений в выполнении функции дыхания. Для деревьев, например, наблюдается особенно большое развитие поверхности(листовая крона), так как диффузионный обмен сквозь поверхность листьев выполняет функцию дыхания. К.А. Тимирязев говорил: «Будем ли мы говорить о питании корня за счёт веществ, находящихся в почве, будем ли говорить о воздушном питании листьев за счет атмосферы или питании одного органа за счёт другого, соседнего, – везде для объяснения мы будем прибегать к тем же причинам: диффузия» (рис 7).
Прежде всего, следует отметить роль диффузионного обмена через поверхность растений в выполнении функции дыхания. Для деревьев, например, наблюдается особенно большое развитие поверхности(листовая крона), так как диффузионный обмен сквозь поверхность листьев выполняет функцию дыхания. К.А. Тимирязев говорил: «Будем ли мы говорить о питании корня за счёт веществ, находящихся в почве, будем ли говорить о воздушном питании листьев за счет атмосферы или питании одного органа за счёт другого, соседнего, – везде для объяснения мы будем прибегать к тем же причинам: диффузия» (рис 7).
Благодаря диффузии кислород из легких пpoникaeт в кровь человека, а из крови – в ткани.
В научной литературе я изучила процесс односторонней диффузии – осмос, т.е. диффузия веществ через полупроницаемые мембраны. Процесс осмоса отличается от свободной диффузии тем, что на границе двух соприкасающихся жидкостей расположено препятствие в виде перегородки (мембраны), которая проницаема только для растворителя и вовсе не проницаема для молекул растворенного вещества (рис 8).
В почвенных растворах содержатся минеральные соли и органические соединения. Вода из почвы попадает в растение путем осмоса через полупроницаемые мембраны корневых волосков. Концентрация воды в почве оказывается выше, чем внутри корневых волосков, поэтому вода проникает в зерно и дает жизнь растению.
1.3. Роль диффузии в быту и технике
Диффузия используется во многих технологических процессах: засолка, получение сахара (стружка сахарной свёклы промывается водой, молекулы сахара диффундируют из стружки в раствор), варка варенья, окрашивание тканей, стирка вещей, цементация, сварка и пайка металлов, в том числе диффузионная сварка в вакууме (свариваются металлы, которые другими методами соединить невозможно, — сталь с чугуном, серебро с нержавеющей сталью и т.д.) и диффузионная металлизация изделий(поверхностное насыщение стальных изделий алюминием, хромом, кремнием), азотирование — насыщение поверхности стали азотом (сталь становится твёрдой, износоустойчивой), цементация — насыщение стальных изделий углеродом, цианирование -насыщение поверхности стали углеродом и азотом [6].
Распространение запахов в воздухе — наиболее часто встречающийся пример диффузии в газах. Почему же запах распространяется не мгновенно, а спустя некоторое время? Дело в том, что во время движения в определенном направлении молекулы пахучего вещества сталкиваются с молекулами воздуха. Траектория движения каждой частицы газа представляет собой ломаную линию, т.к. при столкновениях частицы меняют направление и скорость своего движения.
2. Практическая часть
Как много удивительного и интересного происходит вокруг нас! Многое хочется узнать, попытаться объяснить самостоятельно. Именно для этого я решила провести ряд экспериментов, в ходе которых попыталась выяснить, действительно ли теория диффузии справедлива, находит ли она свое подтверждение на практике. Любую теорию можно считать достоверной лишь в том случае, если она многократно подтверждается экспериментально.
Опыт №1 Наблюдение явления диффузии в жидкостях
Цель: изучить диффузию в жидкости. Пронаблюдать растворение кусочков перманганата калия в воде, при неизменной температуре (при t = 20°С)
Приборы и материалы:стакан с водой, термометр, перманганат калия.
Описание опыта и полученные результаты: Я взяла кусочек перманганата калия и два стакана с чистой водой при температуре 20 °С. Положила в стаканы кусочки перманганата калия и начала наблюдать за происходящим. Через 1 минуту вода в стаканах начинает окрашиваться.
Вода является хорошим растворителем. Под действием молекул воды происходит разрушение связей между молекулами твердых веществ марганцовки.
В первом стакане я не перемешивала раствор, а во втором перемешала. Перемешивая воду (взбалтывая), я убедилась, что процесс диффузии происходит гораздо быстрее (2 минуты)
Перемешивая воду (взбалтывая), я убедилась, что процесс диффузии происходит гораздо быстрее (2 минуты)
Цвет воды в первом стакане становится более интенсивным по истечении времени. Молекулы воды проникают между молекулами перманганата калия, нарушая силы притяжения. Одновременно с силами притяжения между молекулами начинают действовать силы отталкивания и, как следствие, происходит разрушение кристаллической решетки твердого вещества. Процесс растворения марганцовки закончился. Время прохождения эксперимента 3 часа 15 минут. Вода полностью окрасилась в малиновый цвет (рис 9-12).
Можно сделать вывод, что явление диффузии в жидкости — это длительный процесс, в результате которого происходит растворение твердых тел.
Я захотела выяснить, от чего еще зависит скорость протекания диффузии.
Опыт №2 Изучение зависимости скорости протекания диффузии от температуры
Цель: изучить, как температура воды влияет на скорость протекания диффузии.
Приборы и материалы: термометры – 1 шт, секундомер – 1 шт, стаканы – 4 шт, чай, перманганат калия.
Описание опыта и полученные результаты: (опыт приготовления чая при начальной температуре 20°С и при температуре 100° С в двух стаканах).
Взяли два стакана с водой при t=20 °С и t=100 °С. На рисунках показано протекание эксперимента через определенное время от начала: в начале эксперимента — рис.1, через 30 с. — рис.2, через 1 мин. — рис.3, через 2 мин. — рис.4, через 5 мин. — рис 5, через 15 мин. — рис.6. Из этого опыта можно сделать вывод о том, что на скорость протекания диффузии влияет температура: чем больше температура, тем выше скорость протекания диффузии (рис 13-17).
Те же результаты я получила, когда вместо чая взяла 2 стакана с водой. В одном из них была вода комнатной температуры, во втором кипяток.
Я опустила в каждый стакан одинаковое количество перманганата калия. В том стакане, где температура воды была выше, процесс диффузии протекал значительно быстрее (рис.18-23.)
Следовательно скорость диффузии зависит от температуры – чем выше температура, тем интенсивнее происходит диффузия.
Опыт № 3 Наблюдение диффузии с применением химических реактивов [3]
Цель: Наблюдение явления диффузии на расстоянии.
Оборудование: вата, нашатырный спирт, фенолфталеин, пробирка.
Описание опыта: Нальём в пробирку нашатырный спирт. Смочим кусочек ваты фенолфталеином и положим сверху в пробирку. Через некоторое время наблюдаем окрашивание ватки (рис 24-26).
Нашатырный спирт испаряется; молекулы нашатырного спирта проникли к ватке, смоченной фенолфталеином, и та окрасилась, хотя ватка в соприкосновение со спиртом не приводилась. Молекулы спирта перемешались с молекулами воздуха и достигли ватки. Данный опыт демонстрирует явление диффузии на расстоянии.
Молекулы спирта перемешались с молекулами воздуха и достигли ватки. Данный опыт демонстрирует явление диффузии на расстоянии.
Опыт №4. Наблюдение явления диффузии в газах
Цель: изучение изменения диффузии газа в воздухе в зависимости от изменения температуры в помещении.
Приборы и материалы: секундомер, духи, термометр
Описание опыта и полученные результаты:я исследовала время распространения запаха духов в кабинете V=120м3 при температуре t=+200. Засекалось время от начала распространения запаха в комнате, до получения явной чувствительности у людей, стоящих на расстоянии 10 м. от исследуемого объекта (духи). (рис 27-29)
Опыт №5 Растворения кусочков гуаши в воде, при неизменной температуре
Цель: наблюдение диффузии в твердых телах.
Приборы и материалы: три стакана, вода, гуашь трех цветов.
Описание опыта и полученные результаты:
Взяли три стакана, набрали воды t =250С, бросили одинаковые кусочки гуаши в стаканы.
Начали наблюдать за растворением гуаши.
Фотографии сделаны через 1 минуту, 5 минут, 10 минут, 20 минут, растворение закончилось через 4 часа 19 минут (рис 30-34)
Опыт №6 Наблюдение явления диффузии в твердых телах
Цель: наблюдение диффузии в твердых телах.
Приборы и материалы: яблоко, картофель, морковь, раствор «зеленки», пипетка.
Описание опыта и полученные результаты:
Разрезаем яблоко, морковь, картофель «капаем зеленкой» на одну из половинок.
Наблюдаем, как пятно расплывается по поверхности
Разрезаем по месту соприкосновения с зеленкой, чтобы посмотреть насколько глубоко она проникла внутрь (рис 35-37)
Как провести опыт, чтобы подтвердить гипотезу о возможности протекания диффузии в твердых телах? Возможно ли перемешивание веществ в таком агрегатном состоянии? Скорей всего, ответ «Да». Но наблюдать диффузию в твердых телах (очень вязких) удобно с использованием густых гелей. Таким является плотный раствор желатина. Его можно приготовить следующим образом: 4–5 г сухого пищевого желатина растворить в холодной воде. Желатин сначала должен несколько часов набухать, а затем его полностью растворяют при помешивании в воде объемом 100 мл, опустив в сосуд с горячей водой. После охлаждения получается 4-5 % раствор желатина.
Опыт № 7 Наблюдение диффузии с применением густых гелей [3]
Цель: Наблюдение явления диффузии в твердых телах (с применением густого раствора желатина).
Оборудование: 4%-ный раствор желатина, пробирка, небольшой кристаллик марганцовки, пинцет.
Описание и результат опыта:Раствор желатина поместить в пробирку, в центр пробирки быстро, одним движением ввести пинцетом кристаллик марганцовки.
Кристаллик марганцовки в начале опыта
Расположение кристаллика в пузырьке с раствором желатина через 1,5 часа
Уже через несколько минут вокруг кристаллика начнет расти окрашенный в фиолетовый шарик, со временем он становится все больше и больше. Это означает, что вещество кристаллика распространяется во всех направлениях с одинаковой скоростью (рис 38-39)
В твердых телах диффузия происходит, но значительно медленнее чем, в жидкостях и газах.
Опыт № 8 Разница температур в жидкости — тепловая диффузия
Цель: Наблюдение явления тепловой диффузии.
Оборудование: 4 одинаковых стеклянных сосуда, 2 цвета краски, горячая и холодная вода, 2 пластиковые карточки.
Описание и результат опыта:
1. Добавляем немного красной краски в сосуд 1 и 2, синюю краску в сосуды 3 и 4.
2. Наливаем горячую воду в сосуды 1 и 2.
3. Наливаем холодную воду в сосуды 3 и 4.
4. Сосуд 1 накрываем пластиковой картой, переворачиваем вниз горлышком и ставим на сосуд 4.
5. Сосуд 3 накрываем пластиковой картой, переворачиваем вниз горлышком и ставим на сосуд 2.
6. Удаляем обе карты.
Этот опыт демонстрирует эффект тепловой диффузии. В первом случае горячая вода оказывается поверх холодной и диффузия не происходит до тех пор, пока температуры не сравняются. А во втором случае наоборот, внизу горячая, а вверху холодная. И во втором случае молекулы горячей вода начинают стремиться вверх, а молекулы холодной – вниз (рис 41-44).
В первом случае горячая вода оказывается поверх холодной и диффузия не происходит до тех пор, пока температуры не сравняются. А во втором случае наоборот, внизу горячая, а вверху холодная. И во втором случае молекулы горячей вода начинают стремиться вверх, а молекулы холодной – вниз (рис 41-44).
Заключение
В ходе данной исследовательской работы можно сделать вывод о том, что диффузия играет огромную роль в жизни человека и животных.
В ходе данной исследовательской работы можно сделать вывод о том, что продолжительность диффузии зависит от температуры: чем выше температура, тем быстрее протекает диффузия.
Я изучила явление диффузии на примере различных веществ.
Скорость протекания зависит от рода вещества: в газах она протекает быстрее, чем в жидкостях; в твердых телах диффузия протекает значительно медленнее. Это утверждение можно объяснить так: молекулы газов свободны, находятся на расстояниях много больше размеров молекул, двигаются с большими скоростями. Молекулы жидкостей расположены также беспорядочно, как и в газах, но значительно плотнее. Каждая молекула, находясь в окружении соседних молекул, медленно перемещается внутри жидкости. Молекулы твердых веществ совершают колебания около положения равновесия.
Это утверждение можно объяснить так: молекулы газов свободны, находятся на расстояниях много больше размеров молекул, двигаются с большими скоростями. Молекулы жидкостей расположены также беспорядочно, как и в газах, но значительно плотнее. Каждая молекула, находясь в окружении соседних молекул, медленно перемещается внутри жидкости. Молекулы твердых веществ совершают колебания около положения равновесия.
Существует тепловая диффузия.
Список используемой литературы
Генденштейн, Л.Э. Физика. 7 класс. Часть 1 / Л.Э. Генденштейн, А.Б, Кайдалов. – М: Мнемозина, 2009.-255 с.;
Кириллова, И.Г. Книга для чтения по физике для учащихся 7 классов средней школы / И.Г. Кириллова.- М.,1986.-207 с.;
Ольгин, О. Опыты без взрывов / О. Ольгин.- М.: Химик, 1986.-192 с.;
Опыты без взрывов / О. Ольгин.- М.: Химик, 1986.-192 с.;
Перышкин, А.В. Учебник по физике 7 класс / А.В. Перышкин.- М., 2010.-189 с.;
Разумовский, В.Г. Творческие задачи по физике / В.Г. Разумовский.– М.,1966.-159 с.;
Рыженков, А.П. Физика. Человек. Окружающая среда: Приложение к учебнику физики для 7-го класса общеобразовательных учреждений / А.П. Рыженков.– М.,1996.- 120 с.;
Чуянов, В.А. Энциклопедический словарь юного физика / В.А. Чуянов.- М., 1984.- 352 с.;
Шабловский, В. Занимательная физика / В. Шабловский. С.-П., Тригон, 1997.-416 с.
Приложение
рисунок 1
рисунок 2
рисунок 3
рисунок 4
рисунок 5
рисунок 6
рисунок 7
Частицы растворителя (синие) способны пересекать мембрану,
частицы растворённого вещества (красные) — нет.
рисунок 8
рисунок 9
рисунок 10
рисунок 11
рисунок 12
рисунок 13
рисунок 14
рисунок 15
рисунок 16
рисунок 17
рисунок 18
рисунок 19
рисунок 20
рисунок 21
рисунок 22
рисунок 23
рисунок 24
рисунок 25
рисунок 26
рисунок 27
рисунок 28
рисунок 29
рисунок 30
рисунок 31
рисунок 32
рисунок 33
рисунок 34
рисунок 35
рисунок 36
рисунок 37
рис 38
рис 39
рис 40
рис 41
рис 42
рис 43
рис 44
Просмотров работы: 9387
Формула перманганата калия – структура, свойства, применение, примеры вопросов
Калий (K) – это химический элемент, и его атомный номер равен 19 в периодической таблице. Калий — это серебристо-белый металл, достаточно мягкий, чтобы его можно было разрезать ножом с небольшим усилием. Он реагирует с кислородом с образованием хлопьевидной белой перекиси калия. Перманганат представляет собой химическое соединение, содержащее ион манганата (VII), MnO⁻₄, сопряженное основание марганцовой кислоты. Поскольку атом марганца находится в степени окисления +7, ион перманганата (VII) является сильным окислителем.
Калий — это серебристо-белый металл, достаточно мягкий, чтобы его можно было разрезать ножом с небольшим усилием. Он реагирует с кислородом с образованием хлопьевидной белой перекиси калия. Перманганат представляет собой химическое соединение, содержащее ион манганата (VII), MnO⁻₄, сопряженное основание марганцовой кислоты. Поскольку атом марганца находится в степени окисления +7, ион перманганата (VII) является сильным окислителем.
Перманганат калия
Перманганат калия представляет собой неорганическое химическое соединение. Это соединение состоит из двух ионов: иона перманганата (MnO – 4 ) и иона калия (K + ). Это темно-фиолетовое твердое вещество без запаха. При растворении перманганата калия в воде образуется раствор фиолетового цвета. Он известен как сильный окислитель и не образует токсичных продуктов. Его получают из других минералов, таких как оксид марганца.
Формула перманганата калия
Химическая формула перманганата калия KMnO – 4 .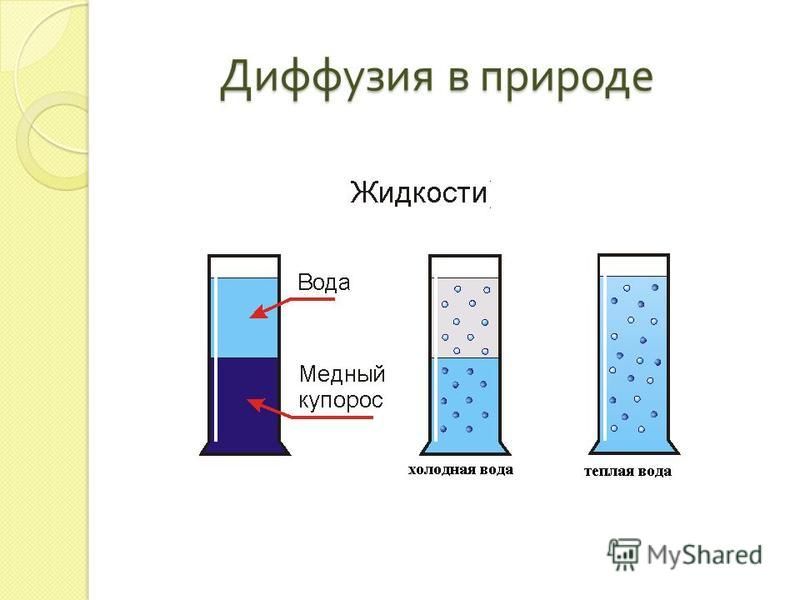
Структура перманганата калия
Между катионом калия и анионом перманганата существует ионная связь.
Получение перманганата калия
- Перманганат калия получают путем смешивания раствора КОН и порошкообразного оксида марганца с окислителями, такими как хлорат калия. Эту смесь кипятят и выпаривают, а остаток нагревают в железных сковородах до тех пор, пока он не приобретет пастообразную консистенцию.
6KOH + 3MNO 2 + 6KCLO 3 → 3K 2 MNO 4 + 6KCL + 3H 2 O
IS -MANGAT Образовавшийся затем кипятят с водой и хлором, и в жидкость пропускают озонированный воздух до тех пор, пока она не превратится в перманганат.
6K 2 MnO 4 + 3Cl 2 → 6KMnO 4 + 6KCl.
Физические свойства перманганата калия
- Молекулярная масса перманганата калия составляет 158,034 г/моль.

- Плотность перманганата калия составляет 2,703 г/см³.
- Температура кипения перманганата калия составляет 100°C.
- Температура плавления перманганата калия составляет 240°C.
- Степень окисления перманганата калия +7.
- Фиолетовое кристаллическое вещество без запаха.
- Растворим в воде и более растворим в кипящей воде. Он может растворяться в ацетоне, уксусной кислоте, метаноле, пиридине, этаноле и органических соединениях.
- Это соединение имеет слегка кислый или горький вкус.
Химические свойства перманганата калия
- Термическое разложение: Перманганат калия подвергается термическому разложению при нагревании.
2KMnO 4 → K 2 MnO 4 + MnO 2 + O 2 .
- Перманганат калия Вступает в реакцию с кислотой: При взаимодействии перманганата с концентрированной соляной кислотой образуется хлор.
 Перманганат калия восстанавливается до щелочного раствора и превращается в зеленый K 2 MnO 4 .
Перманганат калия восстанавливается до щелочного раствора и превращается в зеленый K 2 MnO 4 .
2KMnO 4 + 16HCl → 2KCl + 2MnCl 2 + 5H 2 O + 8Cl 2 .
- Действие щелочей: При нагревании перманганата калия с щелочами он превращается в манганат и выделяется газообразный кислород.
4KMNO 4 + 4KOH → 4K 2 MNO 4 + 2H 2 O + O 2
- Окислительные власти:
- .0016 KMnO 4 действует как очень сильный окислитель в кислых, нейтральных и щелочных средах. Ниже приведены уравнения окисления.
в кислой среде
2KMNO 4 + H 2 SO 4 → K 2 SO 4 + 2MNSO 4 + 3H 2 O + 5 [O] 4 + 3H 2 O + 5 [O]
10 + 3H 2 O + 5 [O] .

MnO – 4 + 8H+ + 5e – → Mn 2 + + 4H 2 O
в нейтральной или щелочной среде
2KMNO 4 + H 2 O → 2KOH + 2MNO 2 + 3 [O]
MNO — 4 + 2H 2 1010. 3E — 4 + 2H 2 11101010107. 3E — 4 + 2H 2 . 3E — 4 + 2H 2 . – → MnO 2 + 4OH –
Использование перманганата калия
- Используется для определения содержания перманганата. Применяется для очистки скважинной воды от сероводорода и железа.
- Он используется в качестве дезинфицирующего средства для лечения определенных кожных заболеваний, таких как грибковые инфекции и дерматиты.
- Может быть при лечении бактериальных инфекций.
- Используется в таких отраслях, как дубление кожи и печать на тканях.

Примеры вопросов
Вопрос 1: Почему перманганат калия известен как хороший окислитель?
Ответ:
Перманганат калия известен как окислитель, так как степень окисления атомов увеличивается, элементы становятся более электроотрицательными. Его можно использовать в качестве окислителя в химическом синтезе многих важных соединений.
Вопрос 2: Какого цвета перманганат калия?
Ответ:
Перманганат калия в физическом состоянии представляет собой твердое вещество без запаха, похожее на кристаллы темно-фиолетового цвета. При растворении в воде раствор приобретает фиолетовый цвет.
Вопрос 3: Почему KMnO 4 является самоиндикатором?
Ответ:
Ионы перманганата теряют розовый цвет, когда они израсходованы в реакции.
 Он рекомендует окончание реакции и поэтому называется самоиндикатором, так как перманганат калия помимо того, что является одним из реагентов, служит индикатором.
Он рекомендует окончание реакции и поэтому называется самоиндикатором, так как перманганат калия помимо того, что является одним из реагентов, служит индикатором.
Вопрос 4: Что происходит, когда перманганат калия реагирует с CO 2 ?
Ответ:
Манганат калия становится пурпурным, когда через раствор пропускают газ CO 2 . CO 2 реагирует с водой с образованием угольной кислоты, как указано ниже: 2 O ⇌ H 2 CO 3
Вопрос 5: Каковы последствия использования перманганата калия?
Ответ:
Может раздражать глаза и кожу человека. . При использовании оставляет пятна на коже или тканях. С перманганатом калия следует обращаться осторожно, при контакте с легко окисляющимися веществами может произойти взрыв.
Вопрос 6: Подкисленный раствор перманганата калия окисляется?
Ответ :
Реакция раствора перманганата с сернистой кислотой.

2MNO — 4 + 5SO 2- 3 + 6H + → 5SO 2- 4 + 2MN + 2 + 3H 2 O + 2 + 3H 2 O
2 + 3H 2 O + 2 + 3H 2 O + 2 + 3H 2 O . окисляет сульфиты.
Вопрос 7: Каковы значения pH при восстановлении раствора KMnO 4 до различных продуктов.
Ответ:
- При pH < 7 восстанавливается до бесцветного раствора Mn 2+
- При pH = 7 образует коричневый осадок MnO 2 .
- При pH > 7 дает зеленый раствор MnO 2- 4 .
Выявление физических и химических изменений
Эта основная идея исследуется через:
- Противопоставление студенческих и научных взглядов
- Критические идеи обучения
- Преподавательская деятельность
Противопоставление студенческих и научных взглядов
Повседневный опыт учащихся
Учащиеся с трудом различают физические и химические изменения, несмотря на формальное обучение, и это различие является несколько произвольным.
 Однако понимание различий между чисто физическими процессами, такими как плавление, испарение и кипение, и изменениями, происходящими в химических реакциях, особенно представление об образовании новых веществ, важно для понимания химии, и учащиеся очень часто путают эти два явления. . Типичны следующие разговоры:
Однако понимание различий между чисто физическими процессами, такими как плавление, испарение и кипение, и изменениями, происходящими в химических реакциях, особенно представление об образовании новых веществ, важно для понимания химии, и учащиеся очень часто путают эти два явления. . Типичны следующие разговоры:Пэт (записывая записи группы о праке): Что случилось?
Ким: Он зашипел.
Пэт: Вы видели какие-нибудь новые вещества?
Ким: Нет.Сэм: Что мне записать образовалось?
Крис: Синий цвет.Исследование: Loughran, Mulhall & Berry (2002)
Исследования показывают, что учащиеся часто используют термин «химическое изменение» для описания изменений в физическом состоянии. Замораживание и кипение считаются примерами химических реакций. Это зависит от их представления о субстанции. Если учащиеся рассматривают лед как вещество, отличное от жидкой воды, они, вероятно, будут классифицировать таяние льда как химическое изменение.
 Одно исследование показало, что 80% студентов считают разницу в цвете между реагентом и продуктом свидетельством химического изменения. Учащиеся могут рассматривать растворение перманганата калия (кристаллы Конди) в воде как химическое изменение из-за сильной разницы в цвете. Некоторые студенты также считали плавление и расширение при нагревании свидетельством химических изменений.
Одно исследование показало, что 80% студентов считают разницу в цвете между реагентом и продуктом свидетельством химического изменения. Учащиеся могут рассматривать растворение перманганата калия (кристаллы Конди) в воде как химическое изменение из-за сильной разницы в цвете. Некоторые студенты также считали плавление и расширение при нагревании свидетельством химических изменений.Исследование: Driver, Rushworth & Wood-Robinson (1994)
Многие учащиеся не понимали, что химическое изменение характеризуется образованием вещества, свойства которого отличаются от свойств исходного вещества, и значительная часть учащихся, которые это сделали, не смогли предложить подходящие причины для выделения «нового» вещества.
Исследование: Driver, Rushworth & Wood-Robinson (1994)
Учащиеся могут полагать, что вспенивание пива является примером химического изменения, а созревание яблока — физическим изменением.
Исследование: Цапарлис (2003)
Студенты обычно считают, что физические изменения обратимы, а химические – нет.
 Студенты также часто считают, что исходное вещество в химической реакции полностью и навсегда исчезает. Обычным повседневным применением обратимой химической реакции является зарядка и разрядка перезаряжаемых аккумуляторов, в том числе автомобильных аккумуляторов; однако учащиеся могут полагать, что батареи являются контейнером накопленного электричества, а не химических веществ, которые реагируют таким образом, что химическая энергия преобразуется в электрическую.
Студенты также часто считают, что исходное вещество в химической реакции полностью и навсегда исчезает. Обычным повседневным применением обратимой химической реакции является зарядка и разрядка перезаряжаемых аккумуляторов, в том числе автомобильных аккумуляторов; однако учащиеся могут полагать, что батареи являются контейнером накопленного электричества, а не химических веществ, которые реагируют таким образом, что химическая энергия преобразуется в электрическую.Другое распространенное мнение состоит в том, что химические изменения вызываются смешиванием веществ/реагентов или что необходимо добавить тепло (которое считается некоторой формой материала).
Научная точка зрения
При физическом изменении внешний вид или форма материи меняется, но вид материи в веществе не меняется. Однако при химическом изменении изменяется вид материи и образуется по крайней мере одно новое вещество с новыми свойствами.
Различие между физическими и химическими изменениями нечеткое.
 Часто студентов убеждают, что изменение является либо физическим, либо химическим. На самом деле это следует рассматривать скорее как континуум. Например, растворение соли в воде обычно считается физическим изменением, однако химические вещества в солевом растворе (гидратированные ионы натрия и хлора) отличаются от веществ в твердой соли. Растворение растворимого кофе в воде кажется физическим изменением, но в большинстве случаев растворение сопровождается изменением энергии и, вероятно, лучше рассматривать его как химический процесс, хотя исходные компоненты можно восстановить физическими средствами. Многие примеры растворения материалов (например, алка-зельтер в воде, металл в кислоте и воздействие кислотных дождей на мрамор и бетон) связаны как с химическими, так и с физическими процессами.
Часто студентов убеждают, что изменение является либо физическим, либо химическим. На самом деле это следует рассматривать скорее как континуум. Например, растворение соли в воде обычно считается физическим изменением, однако химические вещества в солевом растворе (гидратированные ионы натрия и хлора) отличаются от веществ в твердой соли. Растворение растворимого кофе в воде кажется физическим изменением, но в большинстве случаев растворение сопровождается изменением энергии и, вероятно, лучше рассматривать его как химический процесс, хотя исходные компоненты можно восстановить физическими средствами. Многие примеры растворения материалов (например, алка-зельтер в воде, металл в кислоте и воздействие кислотных дождей на мрамор и бетон) связаны как с химическими, так и с физическими процессами.– Исследование: Fensham (1994)
Большинство химических реакций обратимы, хотя на практике это может быть сложно. Во многих учебниках по естествознанию для младших классов утверждается, что химические изменения необратимы, в то время как физические изменения можно обратить вспять.
 Разрезание бумаги на мелкие кусочки или дробление камня — очевидные физические изменения, но восстановить первоначальный лист бумаги или камень сложно. Аккумуляторы используют одну химическую реакцию при разрядке, а перезарядка включает обратную реакцию, превращая продукты обратно в исходные реагенты. Электрический генератор (генератор переменного тока) в автомобиле постоянно подзаряжает автомобильный аккумулятор при работающем двигателе автомобиля.
Разрезание бумаги на мелкие кусочки или дробление камня — очевидные физические изменения, но восстановить первоначальный лист бумаги или камень сложно. Аккумуляторы используют одну химическую реакцию при разрядке, а перезарядка включает обратную реакцию, превращая продукты обратно в исходные реагенты. Электрический генератор (генератор переменного тока) в автомобиле постоянно подзаряжает автомобильный аккумулятор при работающем двигателе автомобиля.Критические обучающие идеи
- При физическом изменении природа вещества, частицы, из которых оно состоит, и число частиц остаются неизменными.
- При химическом изменении свойства новых веществ отличаются от первоначальных, частицы другие и количество частиц может измениться.
- Хотя различие между физическими и химическими изменениями является полезным, его следует рассматривать скорее как континуум.
- Химические реакции можно обратить вспять, но на практике это может быть затруднительно.
Изучите взаимосвязь между представлениями о физических и химических изменениях на Картах развития концепций — (состояния вещества, химические реакции)
При обучении физическим и химическим изменениям важно, чтобы учащиеся рассматривали классификацию как континуум.
 Они должны уметь наблюдать ряд изменений и формулировать свое мнение о видах изменений и проблемах, связанных с процессом классификации. Студенты должны прийти к пониманию того, что химические реакции производят новые химические вещества, отличные от исходных материалов, но химические процессы можно обратить вспять. Изучение примеров обратимых химических реакций и рассмотрение того, почему многие химические изменения трудно обратить вспять, может быть очень полезным.
Они должны уметь наблюдать ряд изменений и формулировать свое мнение о видах изменений и проблемах, связанных с процессом классификации. Студенты должны прийти к пониманию того, что химические реакции производят новые химические вещества, отличные от исходных материалов, но химические процессы можно обратить вспять. Изучение примеров обратимых химических реакций и рассмотрение того, почему многие химические изменения трудно обратить вспять, может быть очень полезным.Учебная деятельность
Способствовать осмыслению и разъяснению существующих идей
Следующие задания предназначены для того, чтобы учащиеся определили, а затем усовершенствовали свои представления о физических и химических изменениях. Студентам важно наблюдать за рядом изменений и фиксировать свое мнение о происходящем. Они могли бы зафиксировать это в буклете, где они пишут и рисуют результаты и наблюдения. Их следует поощрять формулировать и фиксировать гипотезы о том, что происходит, зная, что их мнения не будут оцениваться на данном этапе.
Пример этой методики см. в разделе Использование журналов учета электроэнергии в 10-м году.
Это может помочь выявить их существующие идеи и помочь им бросить вызов и расширить свои существующие убеждения.
Студенты могут исследовать:
- Нагревание стальной ваты на воздухе и сбор полученного черного порошка, затем взвешивание реагента и продукта (должно быть увеличение). Это можно сделать как POE (Предсказать-Наблюдать-Объяснить): студентов просят предсказать, что произойдет с весом стальной ваты, когда она сгорит. Что было добавлено к стальной вате во время горения?
- Растворение сахара и соли в воде и сравнение того, что происходит с электропроводностью двух растворов в процессе растворения. Восстановление соли путем испарения показывает, что соль все еще там, но проводимость указывает на то, что образуется что-то новое.
- Сравните кипящую воду со смесью уксуса и пищевой соды — оба производят пузыри, но в чем разница? Пищевая сода и уксус могут быть смешаны в пакете для сэндвичей Ziploc, чтобы показать производство нового вещества, которое взрывает пакет.

- Реакции осаждения, особенно те, которые приводят к явному изменению цвета, такие как соли Эпсома и раствор аммиака. Это можно сравнить с добавлением марганцовки в воду. Каковы различия?
- Кислотно-основные реакции можно проиллюстрировать с помощью индикаторов как природных (капустный сок), так и синтетических. Изменения цвета помогают проиллюстрировать, что могут образовываться новые материалы.
Практика использования научной модели или идеи и формирование осознанной полезности
Важно, чтобы примеры изменений не ограничивались только материалами и химическими веществами, которым учащиеся подвергаются в классе. В качестве домашнего задания учащихся можно попросить собрать примеры изменений, которые они видят вокруг себя, и классифицировать их по своей шкале физических и химических изменений. Некоторые примеры, которые они могут собрать, включают сжигание топлива, приготовление пищи и такие процессы, как пищеварение, дыхание и фотосинтез.
Прояснение и консолидация идей для/посредством общения с другими и с другими
Чтобы закрепить свои взгляды, учащихся в группах можно попросить выбрать два изменения, одно на физическом конце континуума и одно на химическом конце, и объяснить классу, в чем заключаются различия. Общение своих идей с другими может помочь учащимся прояснить и закрепить новые и существующие идеи об изменениях.Практикуйтесь в использовании и формируйте воспринимаемую полезность научной модели или идеи
Наука – это область, в которой более глубокое значение ряда ключевых идей приобретается постепенно путем их использования в различных ситуациях и подчеркивания того, как одна и та же идея помогает смысл многих ситуаций. Это особенно касается ключевых идей в химических науках, которые нельзя «открыть», «доказать» или даже продемонстрировать с помощью экспериментов в классе. И элементы, и соединения (ключевая идея на макроуровне), и атомы и молекулы (которые предполагают то же самое мышление на микроуровне) являются примерами этого, но их полезность можно развить, показав (среди прочего), как они могут помогают разобраться в физических и химических изменениях. Эти идеи могут быть представлены здесь или упомянуты, если они были представлены ранее. Написание химических уравнений в словесной и символической форме может быть введено как полезный способ описания некоторых изменений, которые наблюдали учащиеся, а также для демонстрации преимуществ химических символов в отслеживании элементов (или атомов) способами, недоступными для слов. Если точные химические формулы не могут быть написаны (как в случае с большинством биохимических веществ), радикальное упрощение все же может быть полезным. Например, древесина в основном состоит из целлюлозы, полимера глюкозы, и такое представление, как (C 6 H 10 O 5 ) n можно использовать для отслеживания изменений в таких процессах, как горение.
Эти идеи могут быть представлены здесь или упомянуты, если они были представлены ранее. Написание химических уравнений в словесной и символической форме может быть введено как полезный способ описания некоторых изменений, которые наблюдали учащиеся, а также для демонстрации преимуществ химических символов в отслеживании элементов (или атомов) способами, недоступными для слов. Если точные химические формулы не могут быть написаны (как в случае с большинством биохимических веществ), радикальное упрощение все же может быть полезным. Например, древесина в основном состоит из целлюлозы, полимера глюкозы, и такое представление, как (C 6 H 10 O 5 ) n можно использовать для отслеживания изменений в таких процессах, как горение.Здесь могут помочь модели и схемы. Например, в большинстве школ есть наборы для молекулярного моделирования, которые можно адаптировать, чтобы показать, как молекулы изменились, а атомы перегруппировались в результате изменений.
 Схемы размеров плакатов также могут быть нарисованы учащимися для помощи в объяснениях.
Схемы размеров плакатов также могут быть нарисованы учащимися для помощи в объяснениях.Оспорить некоторые существующие идеи
Хотя трудно продемонстрировать обратимость химических изменений, учащиеся хорошо знакомы с необходимостью подзарядки своих мобильных телефонов, фотоаппаратов и других перезаряжаемых устройств. Это можно было бы просто обсудить, хотя исследование химических реакций, приводящих в действие эти устройства, могло бы стать полезным исследовательским проектом. Предупреждение здесь заключается в том, что большая часть доступной информации может быть очень технической.Поощряйте размышления о том, как изменились идеи учащихся.
Повторное изучение их первоначальных дневниковых записей может способствовать размышлению о том, как изменились взгляды учащихся. Затем учащиеся могут применить свои новые идеи к большему количеству примеров изменений. Для обсуждения видов происходящих изменений и трудностей классификации некоторых изменений как физических или химических можно использовать следующие мероприятия:- Растворение металлов в кислоте (магния и цинка) и тестирование образовавшегося газа.



 Перманганат калия восстанавливается до щелочного раствора и превращается в зеленый K 2 MnO 4 .
Перманганат калия восстанавливается до щелочного раствора и превращается в зеленый K 2 MnO 4 .

 Он рекомендует окончание реакции и поэтому называется самоиндикатором, так как перманганат калия помимо того, что является одним из реагентов, служит индикатором.
Он рекомендует окончание реакции и поэтому называется самоиндикатором, так как перманганат калия помимо того, что является одним из реагентов, служит индикатором. 
 Однако понимание различий между чисто физическими процессами, такими как плавление, испарение и кипение, и изменениями, происходящими в химических реакциях, особенно представление об образовании новых веществ, важно для понимания химии, и учащиеся очень часто путают эти два явления. . Типичны следующие разговоры:
Однако понимание различий между чисто физическими процессами, такими как плавление, испарение и кипение, и изменениями, происходящими в химических реакциях, особенно представление об образовании новых веществ, важно для понимания химии, и учащиеся очень часто путают эти два явления. . Типичны следующие разговоры: Одно исследование показало, что 80% студентов считают разницу в цвете между реагентом и продуктом свидетельством химического изменения. Учащиеся могут рассматривать растворение перманганата калия (кристаллы Конди) в воде как химическое изменение из-за сильной разницы в цвете. Некоторые студенты также считали плавление и расширение при нагревании свидетельством химических изменений.
Одно исследование показало, что 80% студентов считают разницу в цвете между реагентом и продуктом свидетельством химического изменения. Учащиеся могут рассматривать растворение перманганата калия (кристаллы Конди) в воде как химическое изменение из-за сильной разницы в цвете. Некоторые студенты также считали плавление и расширение при нагревании свидетельством химических изменений. Студенты также часто считают, что исходное вещество в химической реакции полностью и навсегда исчезает. Обычным повседневным применением обратимой химической реакции является зарядка и разрядка перезаряжаемых аккумуляторов, в том числе автомобильных аккумуляторов; однако учащиеся могут полагать, что батареи являются контейнером накопленного электричества, а не химических веществ, которые реагируют таким образом, что химическая энергия преобразуется в электрическую.
Студенты также часто считают, что исходное вещество в химической реакции полностью и навсегда исчезает. Обычным повседневным применением обратимой химической реакции является зарядка и разрядка перезаряжаемых аккумуляторов, в том числе автомобильных аккумуляторов; однако учащиеся могут полагать, что батареи являются контейнером накопленного электричества, а не химических веществ, которые реагируют таким образом, что химическая энергия преобразуется в электрическую. Часто студентов убеждают, что изменение является либо физическим, либо химическим. На самом деле это следует рассматривать скорее как континуум. Например, растворение соли в воде обычно считается физическим изменением, однако химические вещества в солевом растворе (гидратированные ионы натрия и хлора) отличаются от веществ в твердой соли. Растворение растворимого кофе в воде кажется физическим изменением, но в большинстве случаев растворение сопровождается изменением энергии и, вероятно, лучше рассматривать его как химический процесс, хотя исходные компоненты можно восстановить физическими средствами. Многие примеры растворения материалов (например, алка-зельтер в воде, металл в кислоте и воздействие кислотных дождей на мрамор и бетон) связаны как с химическими, так и с физическими процессами.
Часто студентов убеждают, что изменение является либо физическим, либо химическим. На самом деле это следует рассматривать скорее как континуум. Например, растворение соли в воде обычно считается физическим изменением, однако химические вещества в солевом растворе (гидратированные ионы натрия и хлора) отличаются от веществ в твердой соли. Растворение растворимого кофе в воде кажется физическим изменением, но в большинстве случаев растворение сопровождается изменением энергии и, вероятно, лучше рассматривать его как химический процесс, хотя исходные компоненты можно восстановить физическими средствами. Многие примеры растворения материалов (например, алка-зельтер в воде, металл в кислоте и воздействие кислотных дождей на мрамор и бетон) связаны как с химическими, так и с физическими процессами. Разрезание бумаги на мелкие кусочки или дробление камня — очевидные физические изменения, но восстановить первоначальный лист бумаги или камень сложно. Аккумуляторы используют одну химическую реакцию при разрядке, а перезарядка включает обратную реакцию, превращая продукты обратно в исходные реагенты. Электрический генератор (генератор переменного тока) в автомобиле постоянно подзаряжает автомобильный аккумулятор при работающем двигателе автомобиля.
Разрезание бумаги на мелкие кусочки или дробление камня — очевидные физические изменения, но восстановить первоначальный лист бумаги или камень сложно. Аккумуляторы используют одну химическую реакцию при разрядке, а перезарядка включает обратную реакцию, превращая продукты обратно в исходные реагенты. Электрический генератор (генератор переменного тока) в автомобиле постоянно подзаряжает автомобильный аккумулятор при работающем двигателе автомобиля. Они должны уметь наблюдать ряд изменений и формулировать свое мнение о видах изменений и проблемах, связанных с процессом классификации. Студенты должны прийти к пониманию того, что химические реакции производят новые химические вещества, отличные от исходных материалов, но химические процессы можно обратить вспять. Изучение примеров обратимых химических реакций и рассмотрение того, почему многие химические изменения трудно обратить вспять, может быть очень полезным.
Они должны уметь наблюдать ряд изменений и формулировать свое мнение о видах изменений и проблемах, связанных с процессом классификации. Студенты должны прийти к пониманию того, что химические реакции производят новые химические вещества, отличные от исходных материалов, но химические процессы можно обратить вспять. Изучение примеров обратимых химических реакций и рассмотрение того, почему многие химические изменения трудно обратить вспять, может быть очень полезным.


 Эти идеи могут быть представлены здесь или упомянуты, если они были представлены ранее. Написание химических уравнений в словесной и символической форме может быть введено как полезный способ описания некоторых изменений, которые наблюдали учащиеся, а также для демонстрации преимуществ химических символов в отслеживании элементов (или атомов) способами, недоступными для слов. Если точные химические формулы не могут быть написаны (как в случае с большинством биохимических веществ), радикальное упрощение все же может быть полезным. Например, древесина в основном состоит из целлюлозы, полимера глюкозы, и такое представление, как (C 6 H 10 O 5 ) n можно использовать для отслеживания изменений в таких процессах, как горение.
Эти идеи могут быть представлены здесь или упомянуты, если они были представлены ранее. Написание химических уравнений в словесной и символической форме может быть введено как полезный способ описания некоторых изменений, которые наблюдали учащиеся, а также для демонстрации преимуществ химических символов в отслеживании элементов (или атомов) способами, недоступными для слов. Если точные химические формулы не могут быть написаны (как в случае с большинством биохимических веществ), радикальное упрощение все же может быть полезным. Например, древесина в основном состоит из целлюлозы, полимера глюкозы, и такое представление, как (C 6 H 10 O 5 ) n можно использовать для отслеживания изменений в таких процессах, как горение. Схемы размеров плакатов также могут быть нарисованы учащимися для помощи в объяснениях.
Схемы размеров плакатов также могут быть нарисованы учащимися для помощи в объяснениях.